题目内容
【题目】酸、碱、盐在生产和生活中有着广泛的应用。
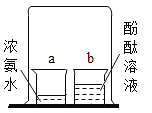
(1)氢氧化钠溶液和氢氧化钙溶液都能使酚酞溶液变红,其原因是二者的溶液中均含有相同的粒子_____(填粒子符号)。
(2)向一定量的稀盐酸和氯化铜的混合溶液中,逐滴加入氢氧化钠溶液至过量,并测得溶液的pH随加入氢氧化钠溶液质量的变化曲线如图所示。
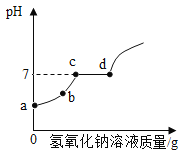
①b点溶液中含有哪些溶质?_____(写化学式)。
②写出c→d段反应的化学方程式_____。
(3)某同学为了除去食盐水中的MgCl2、CaCl2,Na2SO4等杂质,设计了如图所示的实验方案。
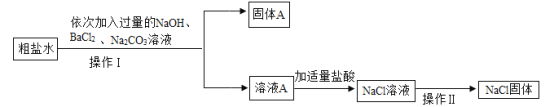
①加入过量Na2CO3溶液的作用是_____。
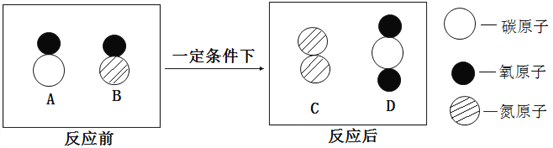
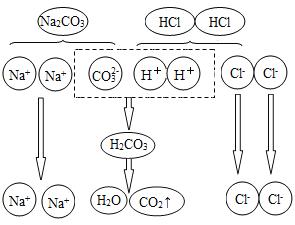
②加适量稀盐酸后反应之一的微观示意图如下,该反应的实质为_____。
【答案】OH- NaCl、HCl、CuCl2 ![]() 除去氯化钙和过量的氯化钡 H+和CO3-结合生成H2O和CO2
除去氯化钙和过量的氯化钡 H+和CO3-结合生成H2O和CO2
【解析】
(1)NaOH溶液和澄清石灰水都能使酚酞溶液变红,其原因是二者的溶液中均含有OH-,故填:OH-;
(2)向一定量的稀盐酸和氯化铜的混合溶液中,逐滴加入氢氧化钠溶液至过量,氢氧化钠先与盐酸反应,pH不断升高,当盐酸完全反应后,氢氧化钠与氯化铜反应。①b点时氢氧化钠与盐酸反应的过程,氢氧化钠与盐酸反应生成氯化钠和水,此时氯化铜还没有与氢氧化钠反应,因此b点溶液中的溶质有氯化钠、氯化氢和氯化铜;故填:NaCl、HCl、CuCl2;
②c→d段是氯化铜与氢氧化钠反应生成氢氧化铜沉淀和氯化钠的过程,此过程中溶液的pH不变,当氯化铜被完全反应掉后,再加入氢氧化钠溶液,溶液的pH会增大;故填:CuCl2+2NaOH═Cu(OH)2↓+2NaCl;
(4)①碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠;碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,所以加入过量的碳酸钠溶液的目的是除去氯化钙和过量的氯化钡;故填:除去氯化钙和过量的氯化钡;
②加适量稀盐酸后反应之一的微观示意图如下,该反应的实质为H+和CO3-结合生成H2O和CO2;故填:H+和CO3-结合生成H2O和CO2
。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案