题目内容
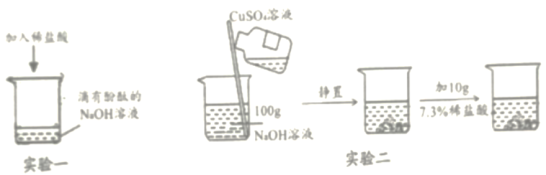
【题目】某食用碱的主要成分是Na2CO3,其中含有少量的NaCl,小明同学为测定该食用碱中Na2CO3的质量分数,他进行了以下实验,取40 g食用碱,加水配成400g的溶液,把溶液平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见下表:
实验一 | 实验二 | 实验三 | 实验四 | |
食用碱溶液的质量 | 100g | 100g | 100g | 100g |
加入CaCl2溶液的质量 | 20g | 40g | 60g | 80g |
生成沉淀的质量 | 2.5g | 5g | m | 8g |
请分析表中数据并计算回答。
(1)m=________;
(2)40 g该食用碱配成的溶液与足量CaCl2溶液反应,最多生成沉淀质量为多少;
(3)该食用碱中Na2CO3的质量分数是?(写出计算过程,答案精确到0.1%)
(4)请根据实验四的数据画图并标上合适的坐标。

【答案】7.5 32 84.8% 
【解析】
(1)由实验一与实验二可知,每20g氯化钙溶液反应后生成2.5g沉淀,则实验三中60g氯化钙反应后生成沉淀的质量为7.5g,小于第四次实验中生成沉淀的质量,所以m的数值为7.5,故填7.5。
(2))由实验一与实验二可知,每20g氯化钙溶液反应后生成2.5g沉淀,则实验四中的氯化钙完全反应后生成沉淀的质量应为10g,可实际生成沉淀的质量为8g,说明氯化钙并没有完全反应,则100g食用碱溶液完全反应,生成沉淀的质量为8g,则40g该食用碱配成的400g溶液如果与足量CaCl2溶液反应,最多生成沉淀质量为32g,故填32。
(3)解:设生成8g沉淀时参加反应的碳酸钠的质量为x

106:100=x:8g
x=8.48g
该食用碱中Na2CO3的质量分数=![]() ×100%≈84.8%
×100%≈84.8%
答:该食用碱中Na2CO3的质量分数是84.8%。
(4)解:由实验一与实验二可知,每20g氯化钙溶液反应后生成2.5g沉淀,则生成8g沉淀时参加反应的氯化钙的溶液的质量=8g×![]() =64g,所以生成沉淀的质量与参加反应的氯化钙溶液的质量关系图像为
=64g,所以生成沉淀的质量与参加反应的氯化钙溶液的质量关系图像为 ,故填
,故填 。
。

【题目】下列选用的除杂试剂和实验操作都正确的是(括号内为杂质)
选项 | 物质 | 除杂选用的试剂和操作 |
A | NaCl固体(Na2CO3)固体 | 加入足量盐酸,搅拌至充分反应,蒸发结晶 |
B | KCl固体(KClO3)固体 | 加入少量的MnO2,加热 |
C | CO2(CO) | 通入足量氧气,点燃 |
D | NaNO3溶液(NaOH溶液) | 加入适量CuSO4溶液,过滤 |
A. AB. BC. CD. D