题目内容
一定质量的铁粉和铜粉的混合物,将其分为两等份,一份与足量的稀盐酸充分反应,产生氢气0.4 g;另一份与足量的硫酸铜充分反应,经过滤、烘干,得固体25.6 g。求混合物中铁的质量分数
46.7%
分析:欲求混合物中铁的质量分数,需求出混合物中铁的质量,根据化学方程式可的出各物质的比例关系,利用比例式可求出一份中铁的质量.然后根据置换反应中物质的关系,求出其中一份中铜的质量.然后根据铁的质量分数=  ×100%计算即可.
×100%计算即可.
解:设与足量的稀盐酸充分反应的铁粉的质量为x,与足量的硫酸铜充分反应中铁置换出的Cu的质量为y
Fe+2HCl=FeCl2+H2↑
56 2
x 0.4g
∴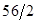 =
=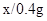
解之得x=11.2g
Fe+CuSO4=FeSO4+Cu
56 64
11.2g y
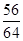 =
=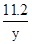
解之得y=12.8g
混合物中铜的质量为:25.6g-12.8g=12.8g
铁的质量分数为: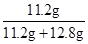 ×100%≈46.7%
×100%≈46.7%
答:混合物中铁的质量分数46.7%.
点评:本题主要考查学生对混合物中物质质量分数的计算能力.学生需正确书写出化学方程式,然后根据化学方程式找出比例关系,列出比例式,正确分析各物质之间的关系,并能正确运用质量分数公式,才能正确答题.
 ×100%计算即可.
×100%计算即可.解:设与足量的稀盐酸充分反应的铁粉的质量为x,与足量的硫酸铜充分反应中铁置换出的Cu的质量为y
Fe+2HCl=FeCl2+H2↑
56 2
x 0.4g
∴
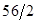 =
=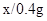
解之得x=11.2g
Fe+CuSO4=FeSO4+Cu
56 64
11.2g y
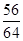 =
=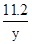
解之得y=12.8g
混合物中铜的质量为:25.6g-12.8g=12.8g
铁的质量分数为:
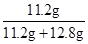 ×100%≈46.7%
×100%≈46.7%答:混合物中铁的质量分数46.7%.
点评:本题主要考查学生对混合物中物质质量分数的计算能力.学生需正确书写出化学方程式,然后根据化学方程式找出比例关系,列出比例式,正确分析各物质之间的关系,并能正确运用质量分数公式,才能正确答题.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
