题目内容
(5分)
某课外兴趣小组对实验室中的一瓶稀硫酸样品进行分析。他们分别用100g稀硫酸与不同质量的锌粒(含杂质,杂质不与稀硫酸反应)反应,三次实验的数据如下表。
请回答下列问题:
(1)第 次实验,锌粒与稀硫酸恰好完全反应。
(2)计算稀硫酸的质量分数(写出计算过程)
某课外兴趣小组对实验室中的一瓶稀硫酸样品进行分析。他们分别用100g稀硫酸与不同质量的锌粒(含杂质,杂质不与稀硫酸反应)反应,三次实验的数据如下表。
| 实验次数 | 1 | 2 | 3 |
| 加入锌粒的质量(g) | 4 | 8 | 12 |
| 充分反应后剩余物质的总质量(g) | 103.9 | 107.8 | 111.8 |
(1)第 次实验,锌粒与稀硫酸恰好完全反应。
(2)计算稀硫酸的质量分数(写出计算过程)
(1)2
(2)9.8%
(5分)解:(1)2 ……………………………………………………(1分)
(2)用恰好完全反应的第2次实验数据进行计算。
8克锌粒完全反应生成氢气的质量是100g+8g-107.8g =" 0.2g" ……(1分)
设生成0.2g氢气需H2SO4的质量为x
Zn + H2SO4 =" ZnSO4" + H2↑ …………………………………………(1分)
98 2
x 0.2g
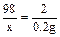 x =" 9.8g " ………………………………(1分)
x =" 9.8g " ………………………………(1分)
该稀硫酸的质量分数为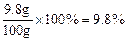 …………………………(1分)
…………………………(1分)
答:略
(2)用恰好完全反应的第2次实验数据进行计算。
8克锌粒完全反应生成氢气的质量是100g+8g-107.8g =" 0.2g" ……(1分)
设生成0.2g氢气需H2SO4的质量为x
Zn + H2SO4 =" ZnSO4" + H2↑ …………………………………………(1分)
98 2
x 0.2g
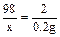 x =" 9.8g " ………………………………(1分)
x =" 9.8g " ………………………………(1分)该稀硫酸的质量分数为
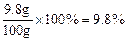 …………………………(1分)
…………………………(1分)答:略

练习册系列答案
相关题目
 果均保留一位小数)
果均保留一位小数)