题目内容
6.5克锌粒与93.7稀硫酸恰好完全反应。请计算:
(1)可产生氢气的质量是多少克?
(2)反应后所得溶液中溶质的质量分数。
(1)可产生氢气的质量是多少克?
(2)反应后所得溶液中溶质的质量分数。
分析:根据题中的叙述列出化学方程式,再依据所给数据和设出的数据找出比例关系进行解答,最后将解出的答案进行总结即可.6.5是纯锌的质量,而93.7是溶液的质量,所以可以直接使用6.5,而不可以用93.7带入化学方程式计算
解:设可产生氢气的质量为X;Zn SO4质量为Y
Zn +H2SO4 =" Zn" SO4 + H2↑ ………………………………………1分
65 161 2
6.5克 Y X ………………………………………1分
 ………………………2分
………………………2分
氢氧化钠溶液中溶质的质量分数为: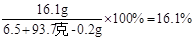 ………………………2分
………………………2分
答:氢氧化钠溶液中溶质的质量分数为16.1%。
点评:在解此类题时,首先书写化学方程式,然后在列出比例关系解答相关数据,最后进行总结即可.
解:设可产生氢气的质量为X;Zn SO4质量为Y
Zn +H2SO4 =" Zn" SO4 + H2↑ ………………………………………1分
65 161 2
6.5克 Y X ………………………………………1分
 ………………………2分
………………………2分氢氧化钠溶液中溶质的质量分数为:
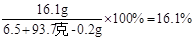 ………………………2分
………………………2分答:氢氧化钠溶液中溶质的质量分数为16.1%。
点评:在解此类题时,首先书写化学方程式,然后在列出比例关系解答相关数据,最后进行总结即可.

练习册系列答案
相关题目