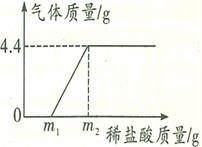
题目内容
(13分)医学上经常用硫酸亚铁糖衣片给贫血患者补铁。某兴趣小组的同学对糖衣片中硫酸亚铁晶体的制备和组成产生了兴趣并对其进行探究。
探究Ⅰ:利用实验室的废水回收铜、制备硫酸亚铁晶体。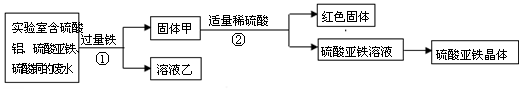
(1)步骤①的化学方程式是 。
(2)固体甲中含有的物质是 (填化学式,下同) ;红色固体是 ;溶液乙中的溶质是 。
探究Ⅱ:硫酸亚铁晶体(FeSO4?xH2O)的化学式。
【查阅资料】
(1)无水硫酸铜粉末遇水会变成蓝色的硫酸铜晶体。
(2)硫酸亚铁晶体加热时,先失去结晶水,高温会继续分解产生金属氧化物和气态非金属氧化物。
【进行实验】
该兴趣小组同学称取2.78g硫酸亚铁晶体(FeSO4?xH2O)样品按图1装置高温加热,使其完全分解,并对所得产物进行分析,并利用SDTQ600热分析仪对硫酸亚铁晶体热分解获得相关数据,绘制成图2所示关系图。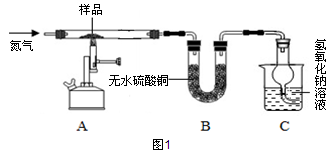
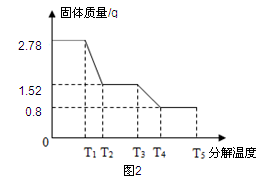
【数据分析】
(1)图1装置B中无水硫酸铜粉末变蓝,说明产物中有 ,该物质的质量为 g。
(2)T3℃时,发生的化学反应为:2FeSO4高温Fe2O3+X↑+SO3↑,其中X的化学式
。
(3)装置C中氢氧化钠溶液的作用是 。
(4)已知FeSO4?xH2O △FeSO4 + xH2O;
计算FeSO4?xH2O中的x。(写出计算过程)
【交流讨论】实验中要持续通入氮气,否则测出的x值会 (填偏大、偏小或不变)。
探究Ⅰ(1)Fe+CuSO4=FeSO4+Cu
(2)Fe和Cu Cu FeSO4 和Al2(SO4)3
探究Ⅱ:【数据分析】(1)H20 1.26 (2)SO2
(3)吸收二氧化硫和三氧化硫,防止污染空气 (4)7 (5) 偏小
解析试题分析:探究Ⅰ(1)根据金属的活动性顺序,铁排在铜的前面,所以步骤①的化学方程式是:Fe+CuSO4=FeSO4+Cu
(2)由于步骤①置换出了铜,而铁又是过量,所以固体甲中含有的物质是:Fe和Cu,在固体混合物中加入稀硫酸,铁会与稀硫酸反应,所以红色固体是Cu,溶液乙中的溶质有未反应的Al2(SO4)3和FeSO4,还有反应生成的FeSO4,所以溶液乙中的溶质是FeSO4 和Al2(SO4)3
探究Ⅱ:【数据分析】(1)根据资料:无水硫酸铜粉末遇水会变成蓝色的硫酸铜晶体,结合图1装置B中无水硫酸铜粉末变蓝,说明产物中有H20,该物质的质量可根据图2判断,2.78g-1.52g=1.26g
(2)根据质量守恒定律的微观解释:化学反应前后,原子的种类和个数都不变,结合化学反应为:2FeSO4 Fe2O3+X↑+SO3↑,不难推出X的化学式SO2
(3)因为FeSO4加热分解会产生SO2和SO3,是一种大气污染物,所以装置C中氢氧化钠溶液的作用是:吸收二氧化硫和三氧化硫,防止污染空气
(4)根据方程式中FeSO4?xH2O或FeSO4与H2O的质量关系,即可求出X的值
方法一: FeSO4?xH2O △ FeSO4 + xH2O
152+18x 18x
2.78g 1.26g
(152+18x)/ 2.78g = 18x/ 1.26g
解得x=7
方法二:FeSO4?xH2O △FeSO4 + xH2O
152 18x
1.52g 1.26g
152/ 1.52g=18x/ 1.26g
解得x=7
(5)实验中要持续通入氮气,就是将FeSO4?xH2O解热反应中产生的物质全部排入到装置B、C中,使得剩余固体质量偏大,测出的x值会偏小
考点:金属的活动性顺序,质量守恒定律的微观解释,实验数据的分析、处理,根据化学方程式计算

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案点燃H2、O2和N2的混合气体20g,充分反应后生成18g水,则剩余的可能是( )
| A.O2和N2的混合气体2g | B.H2和N2的混合气体2g |
| C.H2、O2和N2的混合气体2g | D.2g N2 |
 xNaOH+H2↑+Cl2↑.在20℃时,取100g饱和NaCl溶液进行电解,一段时间后测得产生氯气(Cl2)的质量为7.1g.已知:20℃时,NaC1的溶解度为36g.
xNaOH+H2↑+Cl2↑.在20℃时,取100g饱和NaCl溶液进行电解,一段时间后测得产生氯气(Cl2)的质量为7.1g.已知:20℃时,NaC1的溶解度为36g. Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑