��Ŀ����
����Ŀ��ʵ������һƿ���ܲ������Լ�����ͼ�������ȱ�ı�ǩ��ֻʣ�¡�Na���͡�10%����������֪������ɫҺ�壬�dz��л�ѧ���õ��Լ���Сǿ��С��ͬѧ�ܸ���Ȥ����������ɷֽ���̽����

��������⡿��ƿ�Լ�������ʲô��Һ�أ�
���������ϡ�
���л�ѧ�����ĺ��ƻ�������NaCl��NaOH��Na2CO3��NaHCO3��
��Na2CO3��NaHCO3��Һ���ʼ��ԣ�
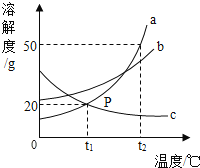
�����£�20����ʱ���������ʵ��ܽ�ȵ��������£�
���� | NaCl | NaOH | Na2CO3 | NaHCO3 |
�ܽ��g | 36 | 109 | 215 | 9��6 |
���ó����ۡ�С�������Լ�ƿ��ע��������������10%���ϱ��е��ܽ�ȵ������жϣ���ƿ�Լ��������� ��
���������롿�ٿ�����NaOH��Һ���ڿ�����Na2CO3��Һ���ۿ�����NaCl��
����Ʋ�ʵ�顿
��1��Сǿ�ýྻ�IJ�����պȡ����Һ����pH��ֽ�ϣ����PH��7������� ����
��2��СǿΪ��ȷ������Һ�ijɷݣ����ֽ���������ʵ�飺
�������� | ʵ������ | ���ۼ���ѧ����ʽ |
ȡ�����Թ��У��μ������� �����Լ������ƣ� | �������������� | �������ȷ |
��ʦָ���ý��۲����ܡ�����������������Һ�ڿ����г��ڷ��ûᷢ�����ʣ����ʺ�Ҳ�ܲ�������������д�����������ڿ����б��ʵĻ�ѧ����ʽ ��
������̽������ȡ�����������CaCl2��Һ���۲쵽�� �����������һ�����Ŀ���� �����ú�ȡ�ϲ���Һ��������ɫ��̪��Һ����Һ�ʺ�ɫ��
��ʵ����ۡ���ƿ��Һԭ���� ��
��̽����ʾ����ʵ��ʱȡ��ҩƷ��Ӧ ��
��3��̽����ƿNaOH��Һ�ı��ʳ̶�
���о�������ȡ10gԭ��Һ����������μ�����������Ϊ7.3%��ϡ���ᣬ��������CO2�������ⶨNa2CO3���������Ӷ���һ��ȷ����Ʒ��NaOH�ı��ʳ̶ȡ�
��������⡿ʵ���ü���ϡ���������CO2�����������ϵ����ͼ��ʾ��

��ش𣺢�A����Һ������������ ���ѧʽ����
��10gԭ��Һ�к�̼���Ƶ����� ����д��������̣�����2�֣�
��10gԭ��Һ��δ���ʵ��������Ƶ����� ��������Ҫд��������̣�
���𰸡����ó����ۡ���ƿ�Լ��������� NaHCO3
����Ʋ�ʵ�顿��1������ �� ����
��2��ϡ���ᣨ���Լ������ƣ�����ѧ����ʽ 2NaOH+CO2=Na2CO3+H2O
������̽�����۲쵽�� ��ɫ���� ������Ŀ���� ����̼���ƣ�
��ʵ����ۡ���ƿ��Һԭ���� NaOH
��̽����ʾ��ʵ��ȡ��ҩƷ��Ӧ ��������ƿ�������Ż�ԭ��
��3����A����Һ������������ NaCl��Na2CO3���ѧʽ��
��10gԭ��Һ�к�̼���Ƶ����� 0.265g
��10gԭ��Һ��δ���ʵ��������Ƶ����� 0.8g
��������
������������ó����ۡ���������ʱ�����ʵ��ܽ�ȣ������̼�����Ƶı�����Һ����������������Ҳ��������10%��������ƿҩƷ����ʹ̼�����ƣ�
����Ʋ�ʵ�顿
��1����pH��ֽ�ϲ�ø���Һ��pH��7��˵������Һ�Լ��ԣ����Ȼ�����Һ�����ԣ����Բ��������Ȼ��ƣ����Ը�ƿ��Һ�������������ƻ���̼���ƣ�
��2�� ȡ������Ʒ���Թ��еμ�ϡ���ᣬ�������������ݣ�����Һ��̼������Һ����Ӧ�ķ���ʽΪNa2CO3+2HCl�T2NaCl+H2O+CO2����������ѡ��ͬ���Լ�ȷ������Һ��ֻҪ�ܺ�̼���Ʒ�����Ӧ�ģ����磺CaCl2 ��BaCl2��Ca(NO3)2��Ba(NO3)2�� Ca(OH)2��Ba(OH)2�� �����ԣ�����ʱ������ɫ���������������ڿ������ױ��������������������̼��Ӧ����̼���ƺ�ˮ��2NaOH+CO2=Na2CO3+H2O��
������̽������ȡ�����������CaCl2��Һ������̼���ƣ���̼�������Ȼ��Ʒ�Ӧ����̼��Ƴ������Ȼ��ƣ��Ȼ��ƺ��Ȼ��Ƴ����ԡ���ȡ��Һ������ɫ��̪������ɫ��̪��ɺ�ɫ��˵����Һ�ʼ��ԣ��������������ƣ�
��������⡿��ͨ��ʵ���֪����ƿ��Һ�к����������ƺ�̼���ơ�����ϡ���ᣬϡ���������������Ʒ�Ӧ����Ӧ��ȫ������̼���Ʒ�Ӧ����A���ʾ����������ϡ����ǡ����ȫ��Ӧ���������У��Ȼ��ƺ�̼���ƣ�
���ɷ�Ӧ��ͼʾ��֪�����ɵĶ�����̼������Ϊ0.11g�����÷�Ӧ�Ļ�ѧ����ʽ������̼�����������̼�������ȼ��ɼ����̼���Ƶ�������
��̼���Ƶ�����Ϊx��
Na2CO3+2HCl==2NaCl+H2O+CO2��
106 44
X 0.11g
106��44=x��0.11g
X= 0.265g
�����������ڿ������ױ��������������������̼��Ӧ����̼���ƺ�ˮ�����÷�Ӧ�Ļ�ѧ����ʽ������̼�������������Ʒ�Ӧ�������ȼ��ɼ���������˵��������Ƶ�������
������˵��������Ƶ�����Ϊy��
2NaOH + CO2 === Na2CO3 + H2O
80 106
Y 0.265g
80��106 =y��0.265g
y=0.2g
10gԭ��Һ�������������Ƶ�����=10g��10%=1g ��
��δ���ʵ��������Ƶ�����=1g-0.2g=0.8g

 ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�����Ŀ��������������龭�ӹ��Ƴɵİ�ɫ��ĩ������̼��ơ������ʵȳɷ֣�����Ҫ��ҩƷ����ױƷԭ�ϣ����г��ϳ��ֵļ�������������������۲�࣬����������������ǣ�
��1��Ϊ��Ѱ�������������۵ķ�������ѧ��ȤС���ͬѧ��������ͼ1ʵ�飺
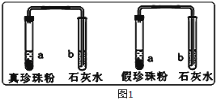
ʵ��һ���ֱ�ȡ������������������֧�Թ��У���һ������ϡ���Ტ������������ͨ�����ʯ��ˮ�У����ֳ���ʯ��ˮ������ǣ�д��ʯ��ˮ����ǵĻ�ѧ����ʽ ��˵���������۾����� ��
ʵ������ֱ�ȡ������������������Ƭ�����գ���������������ŵ��ս���ë��ζ���������δ�ŵ��ս���ë��ζ���ɴ˿ɵó����ۣ���������в��� ��
��2��Ϊ�˱Ƚ�����������̼��Ƶĺ�����������������ʵ�飬ÿ�θ�ȡ5g�������ۣ��ֱ�������ͼ2ʵ��װ����(ϡ��������������������ֻ��̼�����ϡ����ᷴӦ��������)���ⶨ������������������±���
��Ʒ �������ml | ��һ�� | �ڶ��� | ������ |
������� | 117.50 | 117.28 | 117.05 |
������� | 111.52 | 111.66 | 111.86 |
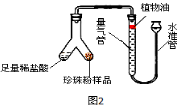
��ͼ2װ�������Եļ�鷽����________����������ˮ���Ϸ���һ��ֲ���͵�Ŀ���� ����ʵ�����ݿ�֪�����������̼��Ƶĺ��� �������(�����������������=��)��
�ڸ������β��������ȡƽ��ֵ�����5g����������ɵ���������Ϊ0.22g�������������Ʒ��CaCO3������������(д���������)