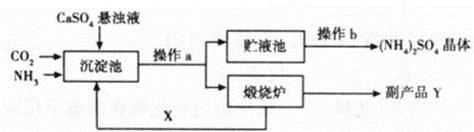
题目内容
某纯碱样品中混有少量的氯化钠,为了测定样品的纯度,小明做了如下实验:准确称取样品12.0g,向其中加入57.9g稀盐酸,恰好完全反应,共产生气体4.4g,请回答下列问题:
(1)小明要从反应后的溶液中提取NaCl应采用的方法是 ;
(2)纯碱样品中的Na2CO3的质量分数是多少?(结果保留一位小数,要求写出计算过程)
(3)反应后所得溶液中NaCl的质量分数是多少?(要求写出计算过程)
(1)蒸发结晶 (2)(3)
解析试题分析:(1)由于氯化钠的溶解度随温度的升高而变化不大,故要从反应后的溶液中提取NaCl应采用的方法是:蒸发结晶
(2)根据反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑,可知产生气体4.4g,即为二氧化碳的质量,再根据CO2与Na2CO3的质量关系,即可求出Na2CO3的质量,进而计算出纯碱样品中的Na2CO3的质量分数,同时根据CO2与NaCl的质量关系,即可求出反应后溶液中NaCl的质量,进而可计算反应后所得溶液中NaCl的质量分数
解:设Na2CO3的质量为x,NaCl的质量为y
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
106:44=x:4.4g
x=10.6g
故纯碱样品中的Na2CO3的质量分数=10.6g/12g×100%=88.3%
(3)117:44=y:4.4g y=11.7g
故反应后溶液中的NaCl的质量=11.7g+(12.0g-10.6g)=13.1g
反应后所得溶液中NaCl的质量分数=13.1g/(12.0g+57.9g-4.4g)×100%=20%
考点:结晶的方法,根据化学方程式计算,溶质质量分数的计算

工业上以CaO和HNO3为原料制备Ca(NO3)2?6H2O晶体.为确保制备过程中既不补充水,也无多余的水,所用硝酸的溶质质量分数约为( )
| A.41.2% | B.53.8% | C.58.3% | D.70.0% |
(5分)铜镁合金常用作飞机天线等导电材料。欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金10g放入烧杯,将200g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下。请计算:
| 次 数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/g | 50 | 50 | 50 | 50 |
| 剩余固体质量/g | 8.5 | 7 | 6.6 | 6.6 |
(2)求所加稀硫酸中溶质的质量分数。(写出计算过程)
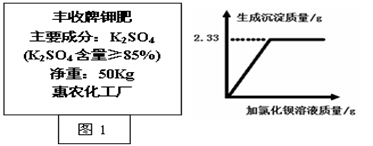
 xNaOH+H2↑+Cl2↑.在20℃时,取100g饱和NaCl溶液进行电解,一段时间后测得产生氯气(Cl2)的质量为7.1g.已知:20℃时,NaC1的溶解度为36g.
xNaOH+H2↑+Cl2↑.在20℃时,取100g饱和NaCl溶液进行电解,一段时间后测得产生氯气(Cl2)的质量为7.1g.已知:20℃时,NaC1的溶解度为36g.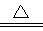 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑