题目内容
【题目】某化学实验小组的同学将镁条投入氯化铜溶液中,发现产生红色固体物质同时又看到溶液中出现较多的气泡。同学们感到很奇怪,金属和盐反应应该生成另一种金属和另一种盐,怎么会出现气泡?于是他们在老师的帮助下展开了探究活动。
【提出猜想】从元素守恒的角度,猜测气体是:
①小红认为是O2 ;②小芳认为是Cl2 ;③小林认为是______。
【查阅资料】Cl2能溶于水,它能与NaOH 溶液反应,生成NaClO和NaCl。
【实验探究】依据上述猜想,实验小组同学开始收集产生的气体进行实验探究。
实验一:小红为了验证自己的猜想,进行的实验操作和对应的现象是 。说明生成的气体不是氧气。
实验二:小芳为了验证自己的猜想,将气体通入盛有NaOH 溶液的洗气瓶中,请写出Cl2与NaOH 溶液反应的化学方程式:________。再称量通气前后洗气瓶的质量,没有改变。说明生成的气体不是氯气。
实验三:小林为了验证自己的猜想,取pH试纸测得氯化铜溶液pH约为4,说明氯化铜溶液中含有较多的 (填离子符号)。
【得出结论】小林的猜想正确。
【实验反思】实验三中测得的结果,是否因为在配制过程氯化铜溶液时引入了杂质?请设计实验排除干扰,你的实验方案是 。
【思维拓展】
(1)其他金属与盐反应,是否也有此现象呢?同学们又做了以下实验:取大小形状都相同的不同金属与不同浓度硫酸铜溶液反应的现象记录如下:
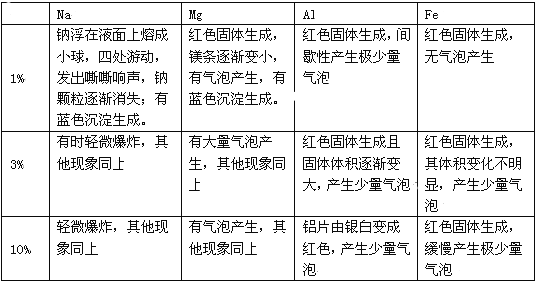
(2)请根据上表中信息,猜想金属与盐产生气体的影响因素有哪些?
【答案】【提出猜想】H2
【实验探究】
实验一:用带火星的木条检验该气体,木条不复燃
实验二:Cl2+2NaOH==NaCl +NaClO+H2O
实验三:H+
【实验反思】重新取纯净的氯化铜固体,溶于蒸馏水,配制新的氯化铜溶液。再用pH试纸测其pH值
【思维拓展】(2)金属的种类及其活动性,盐溶液的种类及其浓度和溶液的酸度
【解析】
试题分析::【提出猜想】反应物中含有氢元素,故还可能产生的是氢气,
【实验探究】
实验一:氧气能使带火星的木条复燃,不是氧气,故不会复燃,
实验二:氯气能与氢氧化钠反应生成氯化钠、次氯酸钠和水,故填:Cl2+2NaOH═NaCl+NaClO+H2O;
实验三:取pH试纸测得氯化铜溶液pH约为4,说明氯化铜溶液中含有较多的氢离子;
【实验反思】要排除是产生杂质的缘故,故需要重新取用纯净的氯化铜固体,故填:重新取纯净的氯化铜固体,溶于蒸馏水,配制新的氯化铜溶液.再用pH试纸测其pH值;
【思维拓展】(2)根据表格提供的数据可以看出,金属的种类、金属的活动性以及盐溶液的种类和浓度以及溶液的酸碱度都会影响金属与盐反应产生气体。
