题目内容
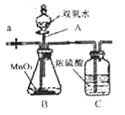
【题目】某工厂废液中含有CuSO4(其他成分不含铜元素),现按以下流程回收金属铜。
![]()
(1)回收过程中,加入适量稀硫酸可除去过量铁屑,该反应的化学方程是为Fe+H2SO4═FeSO4+H2↑,这个反应所属的基本反应类型是 。
(2)洗涤后的滤渣不能用加热的方法干燥,其原因是 。
(3)现有一批废液,其中含4吨CuSO4,理论上可从该废液中回收得到多少吨金属铜?
【答案】
(1)置换反应
(2)加热时,铜要与氧气反应,生成氧化铜,导致会收到的铜不纯
(3)1.6t
【解析】
试题分析:
(1)Fe+H2SO4═FeSO4+H2↑,由一种单质和一种化合物反应,生成另外一种单质和一种化合物的反应,属于置换反应。故填:置换反应。
(2)由于洗涤后的滤渣为金属铜,加热时,铜要与氧气反应,生产氧化铜,导致回收到的铜不纯;故填:加热时,铜要与氧气反应,生成氧化铜,导致会收到的铜不纯。
(3)设理论上可从该废液中回收得到金属铜的质量为x
Fe+CuSO4= FeSO4+Cu
160 64
4t x
![]()
解得x=1.6t
答:理论上可从该废液中回收得到金属铜1.6t。

练习册系列答案
相关题目