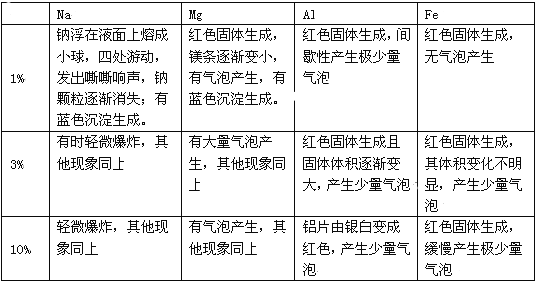
题目内容
【题目】金属及金属材料在生产、生活中有广泛的应用,认识金属的性质有利于我们更好地利用金属。
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是 。(填“符号”)
(2)铁钉在初中化学实验中多次出现,下图展示了光亮铁钉的一系列变化。
![]()
(ⅰ)变化①中发生反应的化学方程式是 。
(ⅱ)变化②中,铁钉主要与空气中的 发生反应。
(ⅲ)变化③中除去铁锈的化学方程式为 。
(ⅳ)如果用a、b、c分别代表光亮的铁钉、锈蚀铁钉、无锈铁钉,则它们的质量由大到小的顺序为 (用字母表示)。
(3)下列几种实验方案中,可用来验证铝、铜、银三种金属的活动性顺序的是 (填序号)
①将铝、银分别浸入到硫酸铜溶液中 ②将银分别浸入到硫酸铝、硫酸铜溶液中
③将铜、银分别浸入到硫酸铝溶液中 ④将铜分别浸入到硫酸铝、硝酸银溶液中
⑤将铝浸入硫酸铜溶液、将铜浸入硝酸银溶液中
(4)在氯化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,得到滤渣和滤液。通过分析,判断:
①滤液中一定含有的溶质是 (填化学式);
②向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是 (填化学式)。
(5)某钢铁厂每天需消耗4900t含Fe2O3 80%的赤铁矿石,根据化学方程式计算出该厂理论上可日产含Fe 98%的生铁的质量是多少?
【答案】
(1)Al
(2)(ⅰ) Fe + CuSO4 = FeSO4 + Cu(ⅱ)O2、H2O (ⅲ)Fe2O3 + 6HCl 2FeCl3 + 3H2O (ⅳ)b>a>c
(3)①④⑤
(4)①MgCl2 ②Cu、Fe(5)2800t
【解析】
试题分析:地壳中含量最多的金属元素是铝元素,变化①中发生反应的化学方程式是Fe + CuSO4 = FeSO4 + Cu。(ⅱ)变化②中,铁钉主要与空气中的水分发生反应。(ⅲ)变化③中除去铁锈的化学方程式为 Fe2O3 + 6HCl 2FeCl3 + 3H2O。(ⅳ)如果用a、b、c分别代表光亮的铁钉、锈蚀铁钉、无锈铁钉,则它们的质量由大到小的顺序为b>a>c,将铝、银分别浸入到硫酸铜溶液中;;④将铜分别浸入到硫酸铝、硝酸银溶液中;⑤将铝浸入硫酸铜溶液、将铜浸入硝酸银溶液中可用来验证铝、铜、银三种金属的活动性顺序,原则是“两金夹一液”,或者“两液夹一金”。 在氯化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,得到滤渣和滤液。①滤液中一定含有的溶质是MgCl2,因为镁的活动性最强,不会被再次置换,;②向滤渣中滴加稀盐酸,有气泡产生,说明有能够和酸的反应的金属存在,则滤渣中一定含有的物质是铜,因为铜先被置换,而镁可能存在,所以一定存在的活泼金属是铁。
解:设可日产含Fe98%的生铁质量为X
3CO + Fe2O3 高温 2Fe + 3CO2
160 112
4900t×80% X×98%
160/112 = 4900t×80%/X×98%
X = 2800t