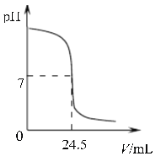
题目内容
【题目】有一包白色粉末,可能是CuSO4、CaCO3、BaCl2、Na2SO4、KOH、KCl中的一种或几种,为证明其组成,进行如下实验:
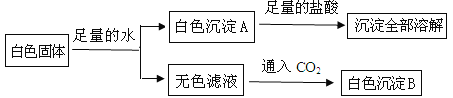
根据上述实验现象判断:
(1)白色沉淀A的化学式是 ;
(2)白色固体中一定不含 ,一定含有 ,可能含有 ;
(3)写出通入CO2生成白色沉淀的化学方程式 , 。
【答案】(1)CaCO3 (2)CuSO4 Na2SO4 , CaCO3 BaCl2 KOH , KCl(4) 2KOH+CO2=K2CO3+H2O;K2CO3+ BaCl2=BaCO3↓+2KCl
【解析】
试题分析:硫酸铜溶于水得到蓝色溶液,题中加入足量的水溶解后是无色的溶液,所以在白色固体中一定不含硫酸铜,同时能形成白色沉淀的有碳酸钙,硫酸钠和氯化钡也可以反应生成白色沉淀,而白色沉淀能全部溶于稀硝酸,硫酸钠和氯化钡反应生成的硫酸钡不溶于稀硝酸,所以白色沉淀A为碳酸钙,所以硫酸钠和氯化钡最多含有一种,向无色滤液中通入CO2气体,得到白色沉淀,通入二氧化碳后产生了白色沉淀,根据题中所给的物质分析,这种白色沉淀只能是碳酸钡,但是二氧化碳不能与氯化钡直接反应生成沉淀,从而我们判断还应该有氢氧化钾,氢氧化钾与二氧化碳反应生成碳酸钾后,碳酸钾与氯化钡反应生成了碳酸钡沉淀,所以原白色粉末中还含有物质的是氯化钡、氢氧化钾,而混合物中是否含有氯化钾对实验现象不会造成影响,所以:
(1)白色沉淀A的化学式是:CaCO3;
(2)白色固体中一定不含:CuSO4、Na2SO4,一定含有:CaCO3、BaCl2、KOH,可能含有KCl;
(3)通入CO2生成白色沉淀的反应是氢氧化钾和二氧化碳反应生成碳酸钾和水,碳酸钾和氯化钡反应生成白色的碳酸钡沉淀和氯化钾,化学方程式为:2KOH+CO2=K2CO3+H2O,K2CO3+BaCl2=BaCO3↓+2KCl.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案