题目内容
【题目】小刚、小军、小红对一久置的NaOH白色粉末的成分进行探究并测定其成分的含量。
一、成分的确定
三位同学都作出以下的猜想:
① 可能是NaOH; ② 可能是Na2CO3; ③ 可能是NaOH与Na2CO3的混合物。
(1)做出②③猜想的依据是______________________ ___(用化学方程式表示)
(2)为了验证①②③猜想,他们分别做了下面的实验。
小刚取少量白色粉末于试管中,再滴加稀HCl,有气泡产生,由此可推出白色粉末中一定含有 ,肯定猜想_____ _(填序号)是错误的。
小军又取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色。由此小军结合小刚的实验,认为猜想③是正确的。小红却认为小军的所得结论不确切,因为____________________________________________________。
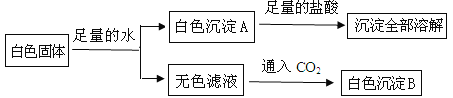
(3)为探究白色粉末是否含有NaOH,小红设计了如下实验方案:

①沉淀B的化学式为__________。
②在操作1中要用到玻璃棒,其作用是____________;在操作2中,除要用到铁架台(带铁圈)、烧杯、滤纸、玻璃棒外,还需补充的玻璃仪器是 ____________。
③小刚认为小红的这个方案也有问题,理由是_____________________ _____但只要稍加改进,就可以证明粉末中还含有NaOH,则小刚改进的方法是 ___________________________ _________。小刚对小红的实验作了正确的改进后进行了实验,实验现象和小红的一致,由此确定猜想③是正确的。
二、各成分含量的测定
三位同学利用电子天平共同作了以下测定实验。

实验数据记录如下:

(4)写出锥形瓶中发生反应化学方程式: ; 。
(5)试通过分析表中数据计算出混合物中试样中各成份的质量分数,
NaOH g ,Na2CO3 g 。
三、实验反思:
(1)有同学提出按上述实验所测得试样中Na2CO3质量分数会偏小,该同学的理由是
(实验操作均正确)。
(2)根据反应的化学方程式分析,NaOH部分变质或全部变质,与没有变质的NaOH相比,中和反应时消耗硫酸的量 (填“相等”、“大于”或“小于”)
【答案】(1)CO2+2NaOH===Na2CO3+H2O(2)Na2CO3;① ; Na2CO3显碱性也会使酚酞试液变红
(3)①CaCO3; ②搅拌;漏斗;③Na2CO3与Ca(OH)2反应后也有NaOH生成,因此这个方案不能证明白色粉末中是否含有NaOH ;改进方案:将滴加澄清石灰水改为过量的CaCl2(或Ba(NO3)2 或Ca(NO3)2或BaCl2)(4)方程式为:2NaOH+H2SO4===Na2SO4+2H2O;Na2CO3+H2SO4===Na2SO4+H2O+CO2↑;
(5)样品中Na2CO3占53%,NaOH占47%
【实验反思】(1)CO2密度比空气大,会有CO2残留在装置中,造成最终测得的质量偏大,测得生成的CO2质量偏小。(或浓硫酸会吸收空气中的水份,造成最终测得的质量偏大,测得生成的CO2质量偏小。)(意思相近均可)(2)相等
【解析】
试题分析:(一)由于久置的氢氧化钠可能与空气中的二氧化碳反应生成碳酸钠和水,配平即可;故答案为:CO2+2NaOH=Na2CO3+H2O
(1)由于碳酸钠与稀盐酸反应时有气泡产生,因此向固体中加入稀盐酸,若观察到有气泡产生,就能说明固体中含有碳酸钠.若固体中含有碳酸钠,就能说明猜想①是错误的.故答案为:①
(2)溶液中存在Na2CO3也会使酚酞变红,因此无色酚酞试液变红时,不能说明一定含有氢氧化钠,说明小军的结论不确切,甚至有可能是错误的.故答案为:碳酸钠也显碱性
(3)向白色粉末中加水,粉末会溶解,为加速溶解,可以用玻璃棒搅拌,从而得到溶液A.因此操作1是溶解,在该操作中玻璃棒所起的作用是“搅拌,加速溶解”.碳酸钠和氢氧化钙反应生成了氢氧化钠和白色沉淀碳酸钙,因此沉淀B是碳酸钙;由于Na2CO3与Ca(OH)2反应后也有NaOH生成,因此这个方案不能证明白色粉末中是否含有NaOH;改进方案:将滴加澄清石灰水改为过量的CaCl2(或Ba(NO3)2或Ca(NO3)2或BaCl2)即可.故答案为:①CaCO3;搅拌作用,加速固体的溶解;②碳酸钠和氢氧化钙反应生成了氢氧化钠;把氢氧化钙改为过量的氯化钙;
(二)设样品中碳酸钠的质量分数为x.
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
10gx 241.20g+10.00g-249.00g=2.20g
106/10gx=44/2.20g , x=53%
试样中碳酸钠的质量分数是53%;那么氢氧化钠的质量分数就为47%
(二)由方程式CO2+2NaOH===Na2CO3+H2O ,Na2CO3+H2SO4═Na2SO4+H2O+CO2↑可得氢氧化钠变质与否消耗的硫酸的量是一样的。