题目内容
【题目】利用中和反应可以测定酸或碱溶液中溶质的质量分数。例如,在一定量的待测酸(或碱)溶液中逐滴加入已知质量分数的碱(或酸)溶液(标准溶液),直到酸、碱正好完全反应,根据消耗标准碱(或酸)溶液的多少即可求算出待测酸(或碱)溶液的质量分数。 右图为某次测定过程中,溶液的pH随所滴加的...某标准溶液体积的变化而变化的关系图。
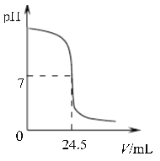
(1)根据右图曲线可以判断实验中是向________________(填“酸”或“碱”,下同)溶液(待测液)中滴加________________溶液(标准液)。
(2)在这次测定中,为了指示中和反应刚好完全,用酚酞作指示剂,即在待测溶液中先滴入几滴酚酞试液,若看到________________, 则证明中和反应恰好完成。
(3)如果实验中使用的酸是硫酸,碱是氢氧化钠,且待测液和标准液的密度均以1.0g/mL计。若测定中取用待测液25mL,标准液溶质的质量分数为4.5%,根据图中数据,计算待测液溶质的质量分数。
【答案】(1)碱;酸;;(2)红色刚好由红色变为无色;(3)3.6%
【解析】
试题分析:(1)溶液最初的pH值大于7,随着反应的进行,pH值逐渐减小,二者恰好完全反应时,pH值等于7,继续滴加pH值小于7,可以推知是向碱溶液中滴加酸溶液。(2)碱性溶液能使酚酞变红,而酸性溶液和中性溶液都不能使酚酞变色,所以中和反应恰好完全完成时,可以看到溶液刚好由红色变为无色。
(3)参加反应的硫酸的质量为:24.5ml×1.0g/ml×4.5%=1.1g
解:设待测液氢氧化钠中溶质质量为x
2NaOH+H2SO4=Na2SO4+2H2O
80 98
x 1.1g
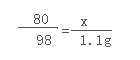
解得x=0.90g 所以氢氧化钠溶液的质量分数为:![]()

练习册系列答案
相关题目