题目内容
【题目】漳州小吃手抓面,制作时要用发到大树碱,大树碱的主要成分是K2CO3.为了测定大树碱中K2CO3的质量分数,小文同学进行了如下实验;
(1)用托盘天平称取10g大树碱样品,在称量过程中发现天平指针如图所示,则此时应进行的操作是_________.

(2)用量筒量取一定量的水,为了准确量取水的体积,还需要使用的仪器是_________.
(3)把大树碱样品和水加入烧杯中,用玻璃棒搅拌,使大树碱完全溶解,玻璃棒的作用是_________.
(4)向配好的溶液中逐渐加入CaCl2溶液,生成1g沉淀(假设大树碱中其它成分不参与反应,反应的化学方程式为CaCl2+K2CO3═CaCO3↓+2KCl).计算大树碱中K2CO3的质量分数.
(5)小文同学在配制好溶液后,发现纸片上还有残留固体,则计算出的大树碱K2CO3的质量分数_________ (填“偏大”或“偏小”)
【答案】(1)往左盘加树碱至天平平衡;(2)胶头滴管;(3)搅拌,加速溶解;
(4)大树碱中K2CO3的质量分数为13.8%;(5)偏小。
【解析】
试题分析:(1)指针偏右,说明左盘大树碱样品小于10g,则此时应进行的操作是往左盘加大树碱,至天平平衡;(2)用量筒量取一定量的水,为了准确量取水的体积,还需要使用的仪器是胶头滴管;(3)溶解中玻璃棒的作用是搅拌,加速溶解;(4)设碳酸钾的质量为x,根据两种盐发生反应的化学方程式
CaCl2+K2CO3═CaCO3↓+2KCl
138 100
x 1g
![]() ,
,
解得x=1.38g,所以大树碱中K2CO3的质量分数:(1.38g÷10g)×100% =13.8%;(5)纸片上还有残留固体,则溶液中溶质偏小,质量分数偏小。

 阅读快车系列答案
阅读快车系列答案【题目】根据如表回答问题.
温度(℃) | 20 | 40 | 50 | 60 | 80 | |
溶解度 (g/100g水) | NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
①20℃时,溶解度最大的物质是
②50℃时,100g水中最多溶解NaCl g
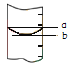
③量筒的局部示意见图,量取水时应沿 视线(选填“a”或“b”)进行读数, 视线(选填“a”或“b”)对应的读数较大.
④A是80℃含有120g水的KNO3溶液,经过如下操作,得到102gKNO3固体.
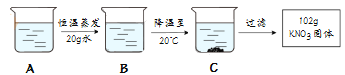
I.A溶液为 (选填“饱和”或“不饱和”)溶液
II.对以上过程的分析,正确的是 (选填编号)
a.A到B的过程中,溶质质量没有改变
b.B中溶质与溶剂的质量比为169:100
c.开始析出KNO3固体的温度在60℃至80℃之间
d.A溶液的质量等于222g.