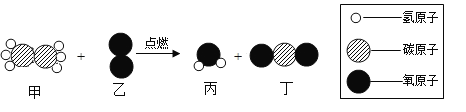
题目内容
【题目】氯化钾和硝酸钾晶体在不同温度时的溶解度如表所示:
温度/℃ 溶解度/g 物质 | 0 | 10 | 20 | 30 | 40 |
KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 |
(1)30℃时,硝酸钾的溶解度为_____;
(2)等质量这两种物质的饱和溶液从40℃降温到10℃时析出晶体更多的是_____;
(3)若两种物质的溶解度相等,此时所对应的温度范围在_____之间;
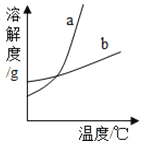
(4)如图中能表示KCl溶解度曲线的是(填“a”或“b”)_____.
【答案】45.8g 硝酸钾(或KNO3) 20℃~30℃ b
【解析】
(1)由表中数据可知,30℃时,硝酸钾的溶解度为45.8g,故答案为:45.8g;
(2)硝酸钾的溶解度受温度的影响较大,降温时会有较多的硝酸钾析出;氯化钾的溶解度受温度的影响较小,降温时析出较少;故答案为:硝酸钾(或KNO3);
(3)硝酸钾和氯化钾在某一温度时具有相同的溶解度时说明两溶解度的图象存在交点,分析知20℃﹣30℃这一区间上它们存在交点;故答案为:20℃~30℃;
(4)由于氯化钾的溶解度随温度变化很不明显,故溶解度曲线较平;故答案为:b。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】某校研究小组对氯酸钾热分解进行以下探究。
[探究一]第一小组通过氧气传感器进行探究,绘制出氧气浓度随温度的变化如图所示。
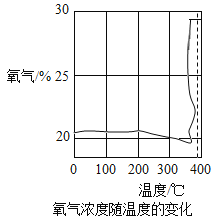
查阅资料:KClO3的熔点约为356°C,MnO2的分解温度约为535°C,用酒精灯给物质加热,受热物质的温度一般约为400°C左右,从图中可知,KClO3分解温度_____(填“>”、“=”或“<”)其熔点。在KCIO3分解前,传感器得到氧气浓度降低的可能原因是____。
[探究二]第二小组发现:氯酸钾与氧化铜混合加热,也能较快产生氧气。于是,按下表进行实验探究,并测定分解温度。
实验编号 | 实验用品 | 分解温度 |
① | 3.0g氯酸钾 | 580 |
② | 3.0g氯酸钾和1.0g二氧化锰 | 350 |
③ | xg氯酸钾和1.0g氧化铜 | 370 |
(1)实验3中x的值应为_____;由对比实验____(填标号),证明氧化铜也会加快氯酸钾的分解,但催化效果更好的物质是_____。
(2)在探究“氧化铜用量与一定质量氯酸钾分解速率关系”时,得出有关实验数据如下:
氧化铜与氯酸钾的质量比 | 1/40 | 1/20 | 1/10 | 1/5 | 1/3 | 1/2 | 2/3 | 1/1 | 2/1 |
生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
分析数据:氧化铜与氯酸钾的质量比为____时,反应速率最快。因此,在化学反应中催化剂的用量_____ (填“是”或“不是”)越多越好。
[探究三]第三小组利用氯酸钾和二氧化锰制取氧气时,发现生成的气体略带颜色,并有刺激性气味。
提出问题:生成的气体中除了氧气外还含有什么物质?
查阅资料:①常温下,氯气是黄绿色、二氧化氯是黄色,都有强烈刺激性气味的气体;
②二氧化氯具有强氧化性,可与硫酸锰溶液反应生成不溶于水的二氧化锰,而氯气不能。
提出假设:
假设1:含有氯气;假设2:含有二氧化氯。
设计实验:
实验步骤 | 实验现象 | 实验结论 |
____ | _____ | 假设2正确 |