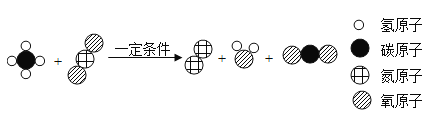��Ŀ����
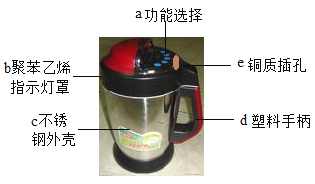
����Ŀ��ij��ѧ��ȤС��Ϊ�ⶨij��ͭ��Ʒ��ͭп�Ͻ���ͭ�ĺ�����������ͼ��ʾ��ʵ�顣����������Ϣ�ش��������⣺

��1��д��ʵ���з�����Ӧ�Ļ�ѧ����ʽ_____��
��2��������֪�����г������������п������X���ı���ʽ_____��
��3���û�ͭ��Ʒ��ͭ����������Ϊ_____��
��4����Ҫʹ������Һ�����ʵ���������Ϊ10%�������ˮ������Ϊ_____��
��5������98%��Ũ�����������õ�ϡ���ᣬ����ҪŨ���������Ϊ_____��
��6������ҵ���ú�Cu2S 80%�Ļ�ͭ��111t�����ƹ����л�ͭ�����ʧ��Ϊ20%����������������ͭ������Ϊ_____��
���𰸡�Zn+H2SO4��ZnSO4+H2�� ![]() ��
��![]() 74% 54.7g 10g 76.8t
74% 54.7g 10g 76.8t
��������
��1��ʵ����ͭ�������Ӧ��п�����ᷴӦ��������п����������Ӧ�Ļ�ѧ����ʽ Zn+H2SO4��ZnSO4+H2����
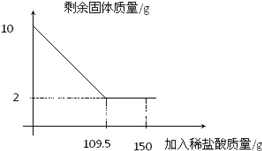
��2�����������غ㶨�ɿɵã����ɵ�����������Ϊ25g+100g��124.8g��0.2g
������п������Ϊx��п������Ϊy�����������ʵ�����Ϊz

x��16.1g
y��6.5g
z��9.8g
������֪�����г������������п������X���ı���ʽ��![]() ��
��![]() ��
��
��3���û�ͭ��Ʒ��ͭ����������Ϊ![]() ��100%��74%��
��100%��74%��
��4����Ҫʹ������Һ�����ʵ���������Ϊ10%���������ˮ������Ϊ![]() ����6.5g+100g��0.2g����54.7g��
����6.5g+100g��0.2g����54.7g��
��5������98%��Ũ�����������õ�ϡ���ᣬ����ҪŨ���������Ϊ��![]() ��10g��
��10g��
��6������ҵ���ú�Cu2S 80%�Ļ�ͭ��111t�����ƹ����л�ͭ�����ʧ��Ϊ20%��������ͭԪ���غ㣬�ɵ�������������������ͭ������Ϊ111t��![]() ����1��20%����74%��76.8t��
����1��20%����74%��76.8t��
�ʴ�Ϊ��
��1��Zn+H2SO4��ZnSO4+H2������2��![]() ��
��![]() ����3��74%����4��54.7g����5��10g����6��76.8t��
����3��74%����4��54.7g����5��10g����6��76.8t��

����Ŀ���ᡢ����Ǿ��꼶��ѧѧϰ����Ҫ֪ʶ���������Ǿ��й㷺����;��
��1�����й����ᡢ��ε�˵����ȷ����________________��
A ����������ܷ�Ӧ�����κ����� B �ܹ������κ�ˮ�ķ�Ӧ�������кͷ�Ӧ
C ��ͼ������Ԫ�� D �ᡢ���֮�䶼�ܷ������ֽⷴӦ
��2����ͼ�֮���ܹ������кͷ�Ӧ����������з�̪������������Һ����μ���ϡ���ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪ________________�����μ�һ����ϡ�������Һ��Ϊ��ɫ����÷�Ӧ����Һ�� pH��6������Һ�д��ڵ�������Ϊ________________ (�����ӷ���)��
��3��ij��ɫ�����п��ܺ���̼���ơ����ᱵ���������ơ�����ͭ�е�һ�ֻ��֣�Ϊȷ���ù� ��ɷ֣��ֽ�������ʵ�飺
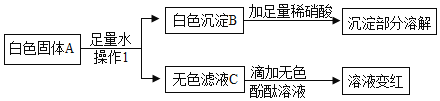
�ٸ�������ʵ�������A ��һ�����е�������________________��C ��һ�����е�������
________________��
��Ϊ��һ��ȷ������ A �п��ܴ��ڵ����ʣ�����Һ C ����ʵ�飬����±���
ʵ����� | ���� | ���� |
________________ | ________________ | A������������ |
��4���� 50 g ϡ������� 50 g ����������Һ��ǡ����ȫ��Ӧ��������Һ�����ʵ��������� Ϊ 5.85%���Լ�������������Һ�����ʵ�����������________________
����Ŀ���Ȼ��غ�����ؾ����ڲ�ͬ�¶�ʱ���ܽ�������ʾ��
�¶�/�� �ܽ��/g ���� | 0 | 10 | 20 | 30 | 40 |
KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 |
��1��30��ʱ������ص��ܽ��Ϊ_____��
��2�����������������ʵı�����Һ��40�潵�µ�10��ʱ��������������_____��
��3�����������ʵ��ܽ����ȣ���ʱ����Ӧ���¶ȷ�Χ��_____֮�䣻
��4����ͼ���ܱ�ʾKCl�ܽ�����ߵ��ǣ�����a������b����_____��