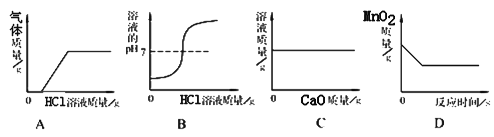
题目内容
【题目】用下列微型实验进行氧气、二氧化碳气体相关性质研究。
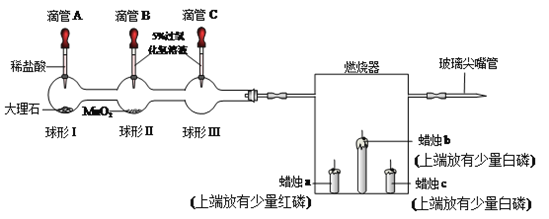
(1)同时挤压滴管B和C,控制相同液体量于球形容器中。
① 写出II反应的化学方程式________________________。
② 有关上述对比实验,说法正确的是__________(填写字母)。
A.MnO2加快反应速率 B.半分钟内球形III中产生气体少
C.反应过程中球形II比球形III内反应剧烈 D.MnO2一定分解产生气体
(2) 微热燃烧器,蜡烛b、c燃烧,蜡烛a不燃烧。写出白磷燃烧的化学方程式________。关于燃烧器中的实验分析正确的是_________(填写字母)。
A.探究可燃物燃烧需要温度达到着火点 B.探究可然物燃烧需要氧气
C.说明红磷与白磷是同素异形体 D.可以比较白磷、红磷着火点的高低
(3)挤压滴管A,将足量稀盐酸滴于球形I中,球形I中产生的现象为____________。一段时间后,蜡烛c熄灭,然后蜡烛b也熄灭了,其原因是_________________________。
(4)蜡烛熄灭后,将玻璃尖嘴管对着涂有澄清石灰水的小烧杯内,烧杯内壁变模糊,此现象 的化学方程式____________,此反应________(选填“能”或“不能”) 证明蜡烛一定含有碳元素。
(5)充分燃烧相同物质的量的碳和磷,消耗氧气物质的量之比为_____________。
【答案】 2H2O2![]() 2H2O+O2↑ ABC 4P+5O2
2H2O+O2↑ ABC 4P+5O2![]() 2P2O5 AD 产生大量气泡 密度比空气大,不可燃,不助燃 CO2+Ca(OH)2=CaCO3↓+H2O 不能 4:5
2P2O5 AD 产生大量气泡 密度比空气大,不可燃,不助燃 CO2+Ca(OH)2=CaCO3↓+H2O 不能 4:5
【解析】(1)①,过氧化氢在二氧化锰的催化作用下,生成水和氧气,反应的化学方程式为:2H2O2![]() 2H2O+O2↑;② A、MnO2在此反应中加快了过氧化氢的分解速率,正确; B、III中的过氧化氢分解较慢,半分钟内球形III中产生气体少,正确;C、二氧化锰加快了过氧化氢的分解速率,故反应过程中球形II比球形III内反应剧烈,正确; D、MnO2 只是加快过氧化氢的分解,本身质量和化学性质都不变,错误;白磷燃烧生成五氧化二磷,化学方程式为:4P+5O2
2H2O+O2↑;② A、MnO2在此反应中加快了过氧化氢的分解速率,正确; B、III中的过氧化氢分解较慢,半分钟内球形III中产生气体少,正确;C、二氧化锰加快了过氧化氢的分解速率,故反应过程中球形II比球形III内反应剧烈,正确; D、MnO2 只是加快过氧化氢的分解,本身质量和化学性质都不变,错误;白磷燃烧生成五氧化二磷,化学方程式为:4P+5O2![]() 2P2O5;燃烧器中的实验是探究可燃物燃烧需要温度达到着火点;可以比较白磷、红磷着火点的高低;(3)大理石的主要成分是碳酸钙,碳酸钙和稀盐酸反应生成二氧化碳气体,故挤压滴管A,将足量稀盐酸滴于球形I中,球形I中产生的现象为产生大量气泡,一段时间后,蜡烛c熄灭,然后蜡烛b也熄灭了,其原因是二氧化碳密度比空气大,不燃烧,也不支持燃烧;(4)蜡烛熄灭后,将玻璃尖嘴管对着涂有澄清石灰水的小烧杯内,烧杯内壁变模糊,是二氧化碳与澄清石灰水反应生成碳酸钙的缘故,此现象的化学方程式为:CaO+H2O
2P2O5;燃烧器中的实验是探究可燃物燃烧需要温度达到着火点;可以比较白磷、红磷着火点的高低;(3)大理石的主要成分是碳酸钙,碳酸钙和稀盐酸反应生成二氧化碳气体,故挤压滴管A,将足量稀盐酸滴于球形I中,球形I中产生的现象为产生大量气泡,一段时间后,蜡烛c熄灭,然后蜡烛b也熄灭了,其原因是二氧化碳密度比空气大,不燃烧,也不支持燃烧;(4)蜡烛熄灭后,将玻璃尖嘴管对着涂有澄清石灰水的小烧杯内,烧杯内壁变模糊,是二氧化碳与澄清石灰水反应生成碳酸钙的缘故,此现象的化学方程式为:CaO+H2O![]() Ca(OH)2,此反应不能证明蜡烛一定含有碳元素,因为空气中也含有一定量的二氧化碳;
Ca(OH)2,此反应不能证明蜡烛一定含有碳元素,因为空气中也含有一定量的二氧化碳;
(5)C+O2![]() CO2,P+
CO2,P+![]() O2
O2![]()
![]() P2O5
P2O5
1mol 2mol 1mol ![]() mol
mol
故充分燃烧相同物质的量的碳和磷,消耗氧气物质的量之比为4:5。

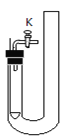
【题目】利用下图装置进行实验。
实验装置 | 实验1 探究燃烧的条件 | 实验2 制取二氧化碳 |
| Ⅰ.燃烧匙中放置一小块白磷(着火点为40℃),装置中盛放80℃的热水(浸没白磷)。 Ⅱ.打开K,从导管口鼓入空气至白磷露出水面,关闭K。 | Ⅰ.燃烧匙中盛有大理石,装置中盛放一定量的稀盐酸(浸没大理石)。 Ⅱ.打开K,收集二氧化碳。 Ⅲ.…… |
(1)实验1中,白磷燃烧的化学方程式为__________________;
(2)实验1中,能证明燃烧需要与氧气接触的实验现象是__________________;
(3)实验2中,制取二氧化碳的化学方程式为__________________;
(4)实验2中,为使反应停止,Ⅲ中的操作是__________________。