题目内容
化学兴趣小组用如图所示装置研究两个问题:
(1)研究燃烧的条件【步骤2】打开K3,关闭K2,打开K1将A中溶液滴入Ⅰ中与B接触,关闭K1.Ⅲ中有气泡冒出,白磷燃烧.Ⅲ中发生反应的化学方程式为 .此实验运用对比的方法研究了燃烧的一个条件,它是 .
(2)研究二氧化碳与氢氧化钠的反应
A中盛有稀硫酸,B为碳酸钠固体,Ⅲ中盛有氢氧化钠溶液.
【实验1】打开K3,关闭K2,打开K1将A中溶液滴入Ⅰ中与B接触,关闭K1.一段时间后,Ⅲ中没有明显现象.
【实验2】证明二氧化碳与氢氧化钠发生了反应,Ⅱ中盛放的可能是 ,后续实验的操作及现象是 .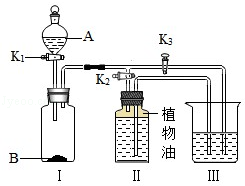
(1)研究燃烧的条件【步骤2】打开K3,关闭K2,打开K1将A中溶液滴入Ⅰ中与B接触,关闭K1.Ⅲ中有气泡冒出,白磷燃烧.Ⅲ中发生反应的化学方程式为 .此实验运用对比的方法研究了燃烧的一个条件,它是 .
(2)研究二氧化碳与氢氧化钠的反应
A中盛有稀硫酸,B为碳酸钠固体,Ⅲ中盛有氢氧化钠溶液.
【实验1】打开K3,关闭K2,打开K1将A中溶液滴入Ⅰ中与B接触,关闭K1.一段时间后,Ⅲ中没有明显现象.
【实验2】证明二氧化碳与氢氧化钠发生了反应,Ⅱ中盛放的可能是 ,后续实验的操作及现象是 .

故答案为:(1)4P+5O2 2P2O5;燃烧需要氧气;
2P2O5;燃烧需要氧气;
(2)稀盐酸;关闭K3,打开K2,Ⅱ中的液体流入Ⅲ中,Ⅲ中有气泡冒出.
 2P2O5;燃烧需要氧气;
2P2O5;燃烧需要氧气;(2)稀盐酸;关闭K3,打开K2,Ⅱ中的液体流入Ⅲ中,Ⅲ中有气泡冒出.
试题分析:(1)白磷燃烧的化学方程式是4P+5O2
 2P2O5;向Ⅲ热水中加入少量白磷,白磷不燃烧;打开K3,关闭K2,打开K1将A中溶液滴入Ⅰ中与B接触,关闭K1.Ⅲ中有气泡冒出,白磷燃烧,因此通入的气体是氧气;通入氧气后白磷燃烧,通过对比探究出燃烧需要氧气的条件;(2)二氧化碳和氢氧化钠反应生成碳酸钠和水,反应没现象;稀盐酸可以和碳酸钠反应生成二氧化碳气体,因此要证明二氧化碳与氢氧化钠发生了反应,Ⅱ中盛放的可能是稀盐酸;关闭K3,打开K2,由于Ⅰ中生成气体,压强增大,将Ⅱ中的液体压入Ⅲ中,Ⅲ中有气泡冒出,说明二氧化碳与氢氧化钠发生了反应.
2P2O5;向Ⅲ热水中加入少量白磷,白磷不燃烧;打开K3,关闭K2,打开K1将A中溶液滴入Ⅰ中与B接触,关闭K1.Ⅲ中有气泡冒出,白磷燃烧,因此通入的气体是氧气;通入氧气后白磷燃烧,通过对比探究出燃烧需要氧气的条件;(2)二氧化碳和氢氧化钠反应生成碳酸钠和水,反应没现象;稀盐酸可以和碳酸钠反应生成二氧化碳气体,因此要证明二氧化碳与氢氧化钠发生了反应,Ⅱ中盛放的可能是稀盐酸;关闭K3,打开K2,由于Ⅰ中生成气体,压强增大,将Ⅱ中的液体压入Ⅲ中,Ⅲ中有气泡冒出,说明二氧化碳与氢氧化钠发生了反应.
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2K2MnO4+K2Mn4O8+4O2↑
2K2MnO4+K2Mn4O8+4O2↑ 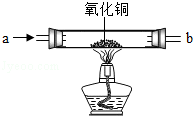
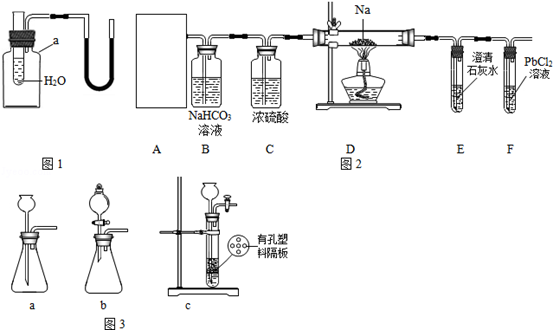
 2Na2O+C
2Na2O+C