题目内容
【题目】某实验小组在做“用澄清石灰水检验二氧化碳”的实验时,发现一个有趣的实验现象:
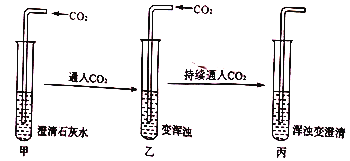
试管中浑浊现象为何消失?实验小组的同学对此实验进行了下列探究活动:
(1)根据已学知识,实验小组对CO2使澄清石灰水变浑浊的现象作出了合理的解释,其化学方程式为____________________。
(2)(查阅资料)
①碳酸盐一般不溶于水。如碳酸钙不溶于水。
②碳酸钙能与二氧化碳、水反应生成碳酸氢钙[Ca(HCO3)2],碳酸氢钙易溶于水。
③碳酸氢钙受热易分解,生成碳酸钙、二氧化碳、水。
从物质组成角度分类,碳酸氢钙应属于(_____)。
A.氧化物 B.酸 C.碱 D.盐
写出碳酸氢钙受热分解的化学方程式__________________________。
(3)(提出问题)碳酸氢钙能与哪些物质反应呢?
(4)(假设与猜想)猜想I:能与盐酸反应
猜想lI:能与氢氧化钠反应
……………
(5)(设计实验并验证)
实验步骤 | 实验现象 | 结论 |
实验一:取丙中少量液体于试管中,滴加稀盐酸 | 有_________生成 | 猜想I成立 |
实验二:取丙中少量液体于试管中,滴加氢氧化钠溶液 | 有白色沉淀生成 | 猜想II成立 |
实验三:取丙中少量液体于试管中,加热 | 澄清液体又变浑浊 | 验证了资料描述 |
根据验证实验写出碳酸氢钙与盐酸反应的化学方程式______________。
(6)(讨论与反思)
该实验小组在实验中发现问题,并对问题进行不断探究。他们不但发现了新的物质,还了解了它的一些性质,并对生活中煮沸可以降低水的硬度、水垢的形成以及自然界中溶洞与钟乳石的形成有了更进一步的认识。
【答案】 CO2+Ca(OH)2==CaCO3↓+H2O D Ca(HCO3)2![]() CaCO3↓+H2O+CO2↑ 气泡 Ca(HCO3)2+2HCl==CaCl2+2H2O+2CO2↑
CaCO3↓+H2O+CO2↑ 气泡 Ca(HCO3)2+2HCl==CaCl2+2H2O+2CO2↑
【解析】(1)二氧化碳通入氢氧化钙溶液中后二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,故澄清石灰水变浑浊,反应方程式为CO2+Ca(OH)2==CaCO3↓+H2O;
(2)氧化物是由两种元素组成,其中一种元素是氧元素的化合物,酸是由氢离子和酸根离子构成,碱是由金属离子和氢氧根离子构成,盐是由金属离子和酸根离子构成,碳酸氢钠是由钠离子和碳酸氢根离子构成,故碳酸氢钠是盐,故选D;碳酸氢钙在加热的条件下分解生成碳酸钙、二氧化碳和水,反应方程式为Ca(HCO3)2![]() CaCO3↓+H2O+CO2↑;
CaCO3↓+H2O+CO2↑;
(5)碳酸氢钙与稀盐酸反应生成氯化钙、二氧化碳和水,故现象为有气泡冒出;反应方程式为Ca(HCO3)2+2HCl==CaCl2+2H2O+2CO2↑。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】请从A或B两题中任选一个作答,若两题均作答,按A计分。
A | B |
太阳能吸附式制冷结露法空气取水器可在野外获取淡水,吸附剂中主要物质为SiO2和CaCl2。 (1)SiO2属于________(填字母序号)。 A.氧化物 B.化合物 C.混合物 (2)CaCl2中钙元素的质量分数为________(写出计算式即可)。 | 水净化过程中常用的消毒剂有:O3、Cl2、Ca(ClO)2、ClO2。 (1)上述物质中,只含一种元素的物质是________。 (2)Ca(ClO)2中钙元素与氧元素的质量比为________。 |
【题目】下列实验设计不能达到实验目的是( )
选项 | A | B | C | D |
实验目的 | 除去CO中的CO2,并回收CO | 探究可燃物燃烧所需的条件 | 除去氧化铜粉末中的铜粉 | 鉴别NH4NO3、CuSO4和NaCl三种白色粉末 |
实验设计 |
|
|
|
|
A. A B. B C. C D. D
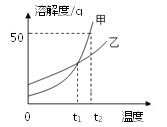
【题目】如图为实验室常见的气体制备、收集和性质的实验装置,据图回答。
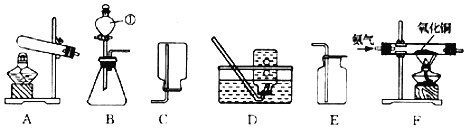
(1)指出B装置中标号仪器名称:①_____。
(2)实验室用大理石与稀盐酸反应制取CO2应选择的发生装置是_____(填装置序号,下同),收集装置是_____,反应的化学方程式是_____。
(3)实验室用加热氯化铵和氢氧化钙固体混合物制取氨气,应选择的发生装置是_____。为探究氨气的性质,小红利用图中F装置进行氨气与氧化铜反应的实验,实验中观察到黑色氧化铜粉末变成红色。
(提出问题)得到的红色粉末是什么?
查阅资料:Cu2O是红色,易与稀硫酸反应:Cu2O+H2SO4=CuSO4+Cu+H2O
(猜想假设)红色粉末是①Cu②Cu2O③_____
(设计实验)小明设计如下实验验证红色粉末中是否含有Cu2O:
实验步骤 | 实验现象 | 实验结论 |
取红色粉未于试管中,加人足量稀硫酸 | _____ | 红色粉末中含有Cu2O |
(实验反思)小明设计的实验无法证明红色粉末中是否含有Cu,原因是_____。