题目内容
【题目】黄铜是一种重要的金属,它是铜和锌的合金,可用来制造机器、电器零件及日常用品。为了测定黄铜样品的组成,取五份样品分别加稀硫酸反应,其实验数据记录如下:
样品 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 |
取样品质量(g) | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 |
取稀硫酸质量(g) | 30.0 | 60.0 | 90.0 | 120.0 | 150.0 |
产生气体质量(g) | 0.3 | 0.6 | 0.9 | 1.0 | 1.0 |
按要求回答下列问题:
(1)根据实验数据分析,从第________份开始,金属已经反应完全了。
(2)列式计算该黄铜样品中金属锌的质量分数。(要求写出计算过程)
【答案】4,81.25%
【解析】
(1)第4份加入120g硫酸生成氢气1.0g,第5份中又多加了30g硫酸,但是生成氢气的质量没变,说明锌已经被反应完了,所以从第4份开始,金属已经反应完了;
(2)设40g样品中含锌的质量为x,
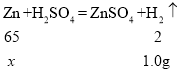
![]() x=32.5g;
x=32.5g;
所以黄铜样品中锌的质量分数为![]() ×100%=81.25%。
×100%=81.25%。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目