题目内容
【题目】在天平的两端各放一只剩有200g18.25%盐酸的小烧杯,调节天平平衡,分别向两烧杯中加入下列各组物质充分反应后天平仍然保持平衡的是( )
A.10.8gMg和10.9gAl
B.30gCaO和50gCaCO3
C.10gAgNO3溶液和5gCu(OH)2
D.4gMg(OH)2和8.4gMgCO3
【答案】AD
【解析】
开始时天平两端加入的盐酸质量相等,需要判断两端加入一定量物质后增加质量是否相等,增加的质量相等时天平仍然保持平衡,不相等时天平发生偏转,可根据化学反应方程式,借助关系式和差量法进行分析比较。
200g18.25%的稀盐酸中HCl质量=200g×18.25%=36.5g
A、设参加反应的铝的质量为![]() ,生成氢气的质量为
,生成氢气的质量为![]()
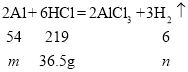
![]()
![]() =9g
=9g
![]()
![]() =1g
=1g
增加的质量=10.9g-1g=9.9g
设参加反应的镁的质量为![]() ,生成氢气的质量为
,生成氢气的质量为![]()
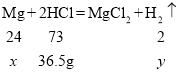
![]()
![]() =12g
=12g
10.8g<12g,因此镁完全反应,盐酸有剩余,生成氢气的质量为
![]()
![]() =0.9g
=0.9g
增加的质量=10.8g-0.9g=9.9g
因此增加的质量相等,故天平平衡;
B、氧化钙与盐酸反应没有气体产生,增加的质量是30g,
而碳酸钙与盐酸反应会生成二氧化碳,增加值是50g与生成的二氧化碳之差,设生成的二氧化碳质量为![]() (由方程式可看出盐酸和碳酸钙恰好完全反应)
(由方程式可看出盐酸和碳酸钙恰好完全反应)
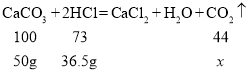
![]()
![]() =22g
=22g
增加的质量为50g-22g=28g,
两边质量增加不相等,故天平不会平衡;
C、硝酸银与盐酸反应不产生气体,因此增加的质量即为加入的硝酸银溶液质量10g:氢氧化铜与盐酸反应不会产生气体,所以增加的质量即为加入溶液的质量5g,所以天平不会平衡;
D、设与8.4g碳酸镁反应时生成的二氧化碳的质量是![]() ,参与反应的盐酸质量为
,参与反应的盐酸质量为![]()
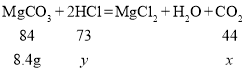
![]()
![]() =7.3g,可见盐酸过量,碳酸镁完全反应
=7.3g,可见盐酸过量,碳酸镁完全反应
![]()
![]() =4.4g
=4.4g
烧杯质量增加了8.4g-4.4g=4g
而氢氧化镁和盐酸反应不放出气体,所以增加4g,所以天平平衡;
故选AD。

 夺冠金卷全能练考系列答案
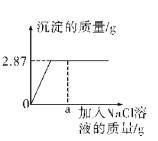
夺冠金卷全能练考系列答案【题目】Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某黄铜的组成,取10g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) | |
第1次 | 10 | m |
第2次 | 10 | 7.4 |
第3次 | 10 | 6.1 |
第4次 | 10 | 5.6 |
第5次 | 10 | 5.6 |
试回答下列问题:
(1)从以上数据可知,最后剩余的5.6g固体的成分是 ;表格中,m= .
(2)黄铜样品中锌的质量分数为 .
(3)计算所用稀硫酸中硫酸的质量分数是多少?
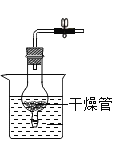
【题目】请设计CO2在高温下与木炭反应生成CO的实验。
(1)在下面方框中,A表示有长颈漏斗和锥形瓶组成的气体发生器,请在A后完成该反应的实验装置示意图_____(夹持装置,连接胶管及尾气处理部分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……,其他可选用的仪器(数量不限)简易表示如下:
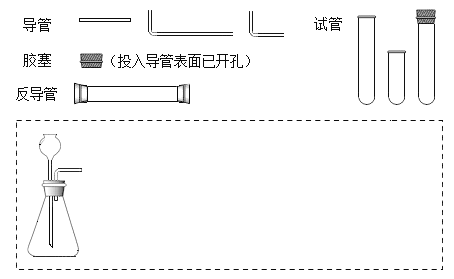
(2)根据方框中的装置图,填写该表_____
仪器符号 | 仪器中所加物质 | 作用 |
A | 石灰石、稀盐酸 | 石灰石与盐酸生成CO2 |
(3)有人对气体发生器作如下改进:在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中。改进后的优点是_____;
(4)验证CO的方法是_____。