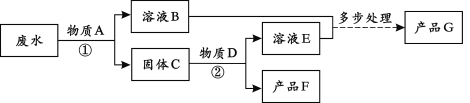
��Ŀ����
����Ŀ��Ϊ�˱Ƚ�������ͬpH��ϡ�����ϡ���ᷴӦ�Ŀ�����ij��ѧ��ȤС���������µ�̽��ʵ�飺
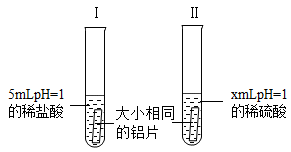
��1������ϡ���ᷴӦ�Ļ�ѧ����ʽΪ��
��2��X=��ʵ������У�����ͨ���۲����Ƚ�����ϡ�����ϡ���ᷴӦ�ľ��ҳ̶ȡ�
��3��ʵ������У���������ϡ���ᷴӦ���Ӿ��ң�ͬѧ����������²��룺
����һ���Թܢ��������ӶԷ�Ӧ���˴ٽ����ã�
��������Թܢ�����������ӶԷ�Ӧ�����谭���ã�
���������������ֲ���ͬʱ������
Ϊ����֤���������Ƿ���ȷ�����Թܢ��м�������������ţ������Թܢ��м�������������ţ������Ա�ʵ�顣
A������ͭB���Ȼ���C��������D��Ũ����
��4��ͨ����3���еĶԱ�ʵ�飬�۲쵽�Թܢ��з�Ӧ���������Ա仯���Թܢ��з�Ӧ���ԼӾ磬�����������
���𰸡���1��2Al+3H2SO4==Al2(SO4)3+3H2��
��2��5���������ݿ�����3��B��C��4����
��������
�����������1������ϡ���ᷴӦ�Ļ�ѧ����ʽΪ2Al + 3H2SO4 == Al2(SO4)3 + 3H2������2����Ϊ�ǶԱ����飬����Һ�����XΪ5mL��ʵ������У�����ͨ���۲�������ݿ������Ƚ�����ϡ�����ϡ���ᷴӦ�ľ��ҳ̶ȡ���3���������е���������֪Ϊ����֤���������Ƿ���ȷ�����Թܢ��м��������Ȼ��ƣ����Թܢ��м����������������Ա�ʵ�顣��4��ͨ����3���еĶԱ�ʵ�飬�۲쵽�Թܢ��з�Ӧ���������Ա仯���Թܢ��з�Ӧ���ԼӾ磬�����������