题目内容
【题目】为探究一瓶久置的氢氧化钠溶液(原溶质质量分数16%)是否变质,同学们提出了多种方案,其中一种方案设计如下:
【查阅资料】:氢氧化钠溶液与空气接触可能发生的反应:
2NaOH+CO2![]() Na2CO3+H2O Na2CO3+CO2+H2O
Na2CO3+H2O Na2CO3+CO2+H2O![]() 2NaHCO3
2NaHCO3
NaOH与NaHCO3在溶液中发生反应: NaOH+NaHCO3![]() Na2CO3+H2O
Na2CO3+H2O
【假设猜想】:1.该溶液未变质,溶质成分只有NaOH
2.该溶液已变质,……
【实验探究】:向一定质量的洁净烧杯中加入m1 g该氢氧化钠溶液,再加入溶质质量分数为20%硫酸m2 g(硫酸足量),充分反应、冷却后称量。根据溶液总质量m判断该氢氧化钠溶液是否变质。试结合该方案, 回答下列问题:
(1)进行上述实验使用的称量仪器名称是 ,称量时,烧杯应放在该仪器的 盘。
(2)实验探究中,烧杯内溶液总质量m与氢氧化钠溶液是否变质的对应关系是:m<(m1 + m2)g,猜想 成立;m=(m1 + m2)g,猜想 成立。
(3)补充完善猜想2:如果该溶液部分变质,溶质的成分为 (填化学式,下同);如果该溶液完全变质,溶质成分可能为Na2CO3或NaHCO3或 。
【答案】(1)托盘天平;左 (2)2;1 (3)NaOH和Na2CO3 ;Na2CO3和NaHCO3
【解析】
试题分析:根据所学知识可知(1)进行上述实验使用的称量仪器名称是托盘天平,使用时按照左物右码的原则进行称量,故称量时,烧杯应放在该仪器的左盘;根据变质是氢氧化钠空气中的二氧化碳反应,会造成溶液的质量增加,故(2)实验探究中,烧杯内溶液总质量m与氢氧化钠溶液是否变质的对应关系是:m<(m1 + m2)g,猜想2成立;m=(m1 + m2)g,猜想1成立。根据题中提供的反应可知(3)补充完善猜想2:如果该溶液部分变质,溶质的成分为NaOH和Na2CO3 ;;如果该溶液完全变质,溶质成分可能为Na2CO3或NaHCO3或Na2CO3和NaHCO3。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】(1)下列食物中酸性最强的是 。
食物 | 葡萄汁 | 苹果汁 | 牛奶 | 鸡蛋清 |
pH | 3.5~4.5 | 2.9~3.3 | 6.3~6.6 | 7.6~8.0 |
(2)硝酸铵、磷酸二氢铵、硝酸钾中,不能与草木灰混用的复合肥料是 。
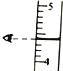
(3)如图为用10mL的量筒量取稀盐酸,所量取的体积是 mL。