题目内容
【题目】某校九年级“我们爱化学”活动小组的同学,在老师的指导下对稀硝酸的性质进行了实验探究。
(实验设计)(1)将紫色石蕊溶液滴入稀硝酸中,预计紫色石蕊溶液由紫色变为_____色;
(2)将铜片加入稀硝酸中,观察现象。
(实验验证)同学们按上述设计进行了实验,却发现紫色石蕊溶液变色后一会儿即褪去,铜片投入稀硝酸后,有气泡冒出,产生无色气体X,无色气体X遇空气变成红棕色有刺激性气味的气体。
(提出问题)(1)紫色石蕊溶液变色后为何会褪色?
(2)上述产生的无色气体X是什么?硝酸具有哪些特性?
(查阅资料)Ⅰ、硝酸具有强氧化性,可与Cu、Zn等多种金属反应生成相应的硝酸盐,但不会生成H2。
Ⅱ、某些气态含氮物质的物理性质如下表所示:
物质 | N2 | NH3 | NO | NO2 |
颜色 | 无色 | 无色 | 无色 | 红棕色 |
溶解性 | 不溶于水 | 极易溶于水 | 不溶于水 | 可溶于水 |
(猜想与分析)(1)小强同学认为紫色石蕊溶液变色后又褪色是由于试管不干净,含有其他杂质造成的,要证明小强的观点,应进行的操作是_____;
(2)大家一致认为红棕色气体是NO2,但对于无色气体X及变化的原因有不同的观点。
①小华同学认为气体X是N2,但遭到大家的一致反对,理由是_____;
②小明同学认为气体X是NH3,也遭到大家的一致反对,理由是_____;
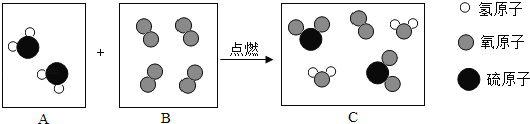
③经讨论,最终大家获得了气体X是NO的共识。NO遇到空气中的氧气生成NO2的化学方程式为_____;
(表达交流)根据探究结果,请分析稀盐酸和铜不反应而稀硝酸却能与铜反应的原因:_____;
(反思拓展)(1)活动小组的同学对硝酸能与Zn反应很感兴趣,便取了一小块锌片投入稀硝酸中,发现锌片溶解,也出现上述Cu与稀硝酸反应的类似现象,确定生成了NO,并在老师的帮助下,测出恰好反应时Zn和HNO3的质量比为65:168,由此获得了Zn与稀硝酸反应的化学方程式为_____;
(2)活动小组的同学在老师的帮助下获得了一定质量分数的硝酸和锌反应对应的产物:质量分数为1%时生成NH4NO3;质量分数为15%时生成N2O;质量分数为50%时生成NO;质量分数为80%时生成NO2,由此可以得到的规律是_____;
(3)将铜片加入足量的浓硝酸中,发现反应后所得溶液呈绿色,活动小组的同学查阅资料得知,这是由于生成的红棕色NO2溶解在溶液中引起的,请设计一个简单的实验证明:_____。
【答案】红 用干净的试管重复实验 氮气化学性质很稳定,所以常温下氮气在空气中不能直接被氧化成二氧化氮 氨气极易溶于水,且不易被氧化 ![]() 铜的金属活动性可知铜的活动性在氢后,所以不会与盐酸反应生成氢气,但由于硝酸具有强氧化性,所以能与铜反应生成一氧化氮等物质
铜的金属活动性可知铜的活动性在氢后,所以不会与盐酸反应生成氢气,但由于硝酸具有强氧化性,所以能与铜反应生成一氧化氮等物质 ![]() 硝酸的浓度越高,得到的化合物中氮元素的化合价越高 加热绿色溶液,有红棕色气体产生,溶液变成蓝色,则说明溶液呈绿色是由于生成的红棕色NO2溶解在溶液中引起的
硝酸的浓度越高,得到的化合物中氮元素的化合价越高 加热绿色溶液,有红棕色气体产生,溶液变成蓝色,则说明溶液呈绿色是由于生成的红棕色NO2溶解在溶液中引起的
【解析】
实验设计:
(1)将紫色石蕊溶液滴入稀硝酸中,紫色石蕊遇酸变红,预计紫色石蕊溶液由紫色变为红色;
猜想与
(1)小强同学认为紫色石蕊溶液变色后又褪色是由于试管不干净,含有其他杂质造成的,要证明小强的观点,应进行的操作是用干净的试管重复实验;
(2)①小华同学认为气体X是N2,但遭到大家的一致反对,理由是氮气化学性质很稳定,所以常温下氮气在空气中不能直接被氧化成二氧化氮;
②小明同学认为气体X是NH3,也遭到大家的一致反对,理由是氨气极易溶于水,且不易被氧化;
③NO遇到空气中的氧气生成NO2的,应的化学方程式为![]() ;
;
表达交流:
根据探究结果,可知稀盐酸和铜不反应而稀硝酸却能与铜反应的原因:铜的金属活动性可知铜的活动性在氢后,所以不会与盐酸反应生成氢气,但由于硝酸具有强氧化性,所以能与铜反应生成一氧化氮等物质;
反思拓展:
(1)由题干信息可知该反应是锌与硝酸反应生成硝酸锌、一氧化氮和水,设该方程式中锌与硝酸的化学计量数分别为x、y,则有![]() ,可得
,可得![]() ,由此获得了锌与稀硝酸反应的化学方程式为
,由此获得了锌与稀硝酸反应的化学方程式为 ![]() ;
;
(2)活动小组的同学在老师的帮助下获得了一定质量分数的硝酸和锌反应对应的产物:质量分数为1%时生成硝酸铵![]() ;质量分数为15%时生成一氧化二氮
;质量分数为15%时生成一氧化二氮![]() ;质量分数50%时生成
;质量分数50%时生成![]() ;质量分数为80%时生成
;质量分数为80%时生成![]() ,由此可以得到的规律是:硝酸的浓度越高,得到的化合物中氮元素的化合价越高;
,由此可以得到的规律是:硝酸的浓度越高,得到的化合物中氮元素的化合价越高;
(3)气体在水中的溶解度随温度的升高而减小,加热后二氧化氮会从溶液中逸出,故设计的实验方案为:加热绿色溶液,有红棕色气体产生,溶液变成蓝色,则说明溶液呈绿色是由于生成的红棕色NO2溶解在溶液中引起的。

【题目】铜镁合金具有优良的导电性,常用作飞机天线等导电材料.欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜合金20g放入烧杯,将280g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下.请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀硫酸质量/g | 70 | 70 | 70 | 70 |
剩余固体质量/g | 18.2 | 16.4 | 14.6 | 13.2 |
(1)合金中铜、镁的质量比.
(2)所加稀硫酸的溶质的质量分数.(写出计算过程)