题目内容
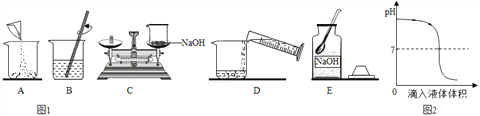
【题目】某研究小组为探究“铁钉在不同溶液中腐蚀的速率”,在相同条件下取同浓度的下列不同溶液用如图装置完成实验,并用手持数据采集器进行测定。回答下列问题:
(1)铁锈的主要成分的化学式为____________
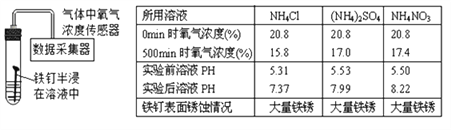
(2)在NH4Cl、(NH4)2SO4、和NH4NO3溶液中,铁钉锈蚀过程中上述溶液的酸性均变____________(填“强”或“弱”)
(3)上述实验方案是否合理?_________(填“合理”或“不合理”),你的理由是__________
(4) 该小组在不同酸碱性溶液中又进行了探究,在相同条件下其测定的实验数据如下图:
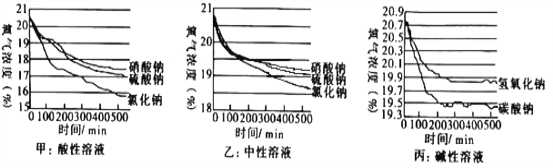
①上述实验中,氧气浓度下降先陡后缓的原因为________________
②根据甲、乙图像,可看出:铁钉在酸性溶液中比在中性溶液中生锈________(填“快”或“慢”, 下同);在开始时PH相同的情况下,甲、乙组中均为含氯离子的溶液生锈________ 。
【答案】 Fe2O3 弱 不合理; 实验前溶液的PH没有保持相同 氧气浓度下降使腐蚀速率变慢。 快 快
【解析】本题主要考查了影响化学反应速率的因素探究,铁锈蚀的原理,溶液的酸碱性与pH值的关系。
(1)铁锈的主要成分是氧化铁,化学式为Fe2O3;
(2)在NH4Cl、(NH4)2SO4、和NH4NO3溶液中,铁钉锈蚀过程中上述溶液的pH都在增大,酸性均变弱;
(3)上述实验方案不合理,理由是:实验前溶液的pH没有保持相同;
(4)①上述实验中,氧气浓度下降先陡后缓的原因为氧气浓度下降使腐蚀速率变慢;
②根据甲、乙图像可知:铁钉在酸性溶液中比在中性溶液中生锈快;在开始时pH相同的情况下,甲、乙组中均为含氯离子的溶液生锈快。

【题目】绿矾(FeSO47H2O)用途广泛,可用作净水剂,医学上可用作补血剂,还可用于制颜料。
(1)绿矾是一种絮凝剂,利用其溶于水后生成的胶状物对杂质的____________,使杂质沉降来达到净水的目的。
(2)缺铁会引起贫血,铁是一种人体必需的__________(填“常量元素”或“微量元素”)。
(3)《本草纲目》中记载,绿矾“煅过变赤,则为绛矾”。绛矾是古代壁画、彩塑中使用的一种红色颜料。
某化学兴趣小组同学对绿矾高温分解的产物很感兴趣,进行了如下探究。
(查阅资料)
①绿矾高温分解的产物是一种固态金属氧化物和几种气态非金属氧化物。
②在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低。
③无水硫酸铜遇水变蓝。
④硫有两种常见的氧化物,部分性质如下表:
硫的氧化物 | 熔点 | 沸点 | 水溶性 | 能否使高锰酸钾溶液褪色 |
SO2 | -75.5℃ | -10℃ | 易溶于水 | 能 |
SO3 | 16.8℃ | 44.8℃ | 易溶于水 | 不能 |
(提出问题)
《本草纲目》中记载绿矾“煅过变赤”,经实验验证绿矾高温分解确实产生红色固体,说明绿矾高温分解产生的一种固态金属氧化物是____________,那么产生的几种气态非金属氧化物是什么呢?
(进行猜想)猜想1:H2O 和____________;
猜想2:H2O 和SO3 ;
猜想3:H2O、SO2和SO3 。
甲同学认为无需通过进一步实验即可判定猜想2错误,理由是_______________________。
(设计实验)
乙同学用以下装置检验绿矾高温分解产生的气态非金属氧化物:
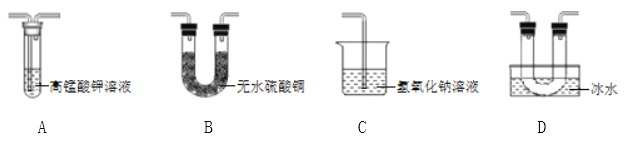
需将绿矾高温分解产生的气体依次通过______________(填字母,且每套装置限用一次)。
(分析现象)进行上述实验,观察到A中试管内溶液________,B中U形管内固体________,D中U形管内出现无色晶体,说明猜想3正确。
(得出结论)绿矾高温分解的化学方程式为_______________________________________。
(拓展延伸)生产硫酸最古老的方法是使绿矾高温分解,将生成的SO3和H2O同时冷凝并发生反应SO3+H2O=H2SO4 ,所以古代称硫酸为“绿矾油”。假定SO3和H2O全部冷凝并充分反应,SO2全部逸出,则通过这个方法得到的硫酸的质量分数为____________(计算结果保留一位小数)。
【题目】小红发现装有膨化食品的包装袋内都充有一定量的气体(如图所示),她和同学对所充气体的作用及成分产生了好奇,于是进行了如下探究。

探究一:包装内填充气体的目的是什么?
(交流讨论)结合膨化食品的实际生产、销售过程,以及人们对食品安全的要求,同学们一致认为在膨化食品包装袋内填充气体的目的是:(1)防止运输过程中膨化食品被压碎;
(2) ______________________________。
小组同学的这一分析得到了老师的肯定,老师还告诉他们,包装袋内填充的是一种初中化学常见气体。
探究二:包装袋内的气体成分是什么?
(猜想与假设)包装袋内的气体为:猜想1:氧气;猜想2:氮气;猜想3:二氧化碳;猜想4:二氧化硫;猜想5:空气。
通过分析,大家认为猜想1是错误的,理由是氧气化学性质比较活泼,食品易与氧气发生缓慢氧化而变质;猜想4也是错误的,理由是_______________________________。
(查阅资料)①镁能与氧气在点燃条件下反应,生成物氧化镁常温下不溶于水也不与水反应;②镁还能在氮气中燃烧,反应生成氮化镁(Mg3N2)固体;③氮化镁在常温下能与水反应生成氨气和一种难溶性碱。
镁与氧气反应的化学方程式为______________________________。
(进行实验)实验一:抽取包装袋内气体一瓶,向其中加入一定量的澄清石灰水,振荡,观察不到石灰水变浑浊的现象,小明据此推断只有猜想2成立。小红不同意此结论,理由是___________________,此现象只能说明猜想不成立。
实验二:另抽取包装袋内气体一瓶,将燃着的木条伸入瓶中。观察到木条立即熄灭,小组同学据此判断猜想__________不成立,猜想2成立。
为进一步确认猜想2成立,小组同学进行了实验三:
实验操作 | 实验现象 | 结论 |
①另取一瓶气体,向其中伸入燃着的镁条,观察现象 ②取少量反应后固体加入足量的蒸馏水中,并滴入__________,振荡观察现象 | 镁条燃烧,发出耀眼白光 得到红色溶液 | 猜想2成立 |
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是
A | B | C | D | |
实 验 装 置 |
|
|
|
|
解释 | 集气瓶中的水:吸收放出的热量 | 量筒中的水:通过水体积的变化测出减少的O2体积 | 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 | 烧杯中的水:加热铜片;隔绝空气 |
A. A B. B C. C D. D