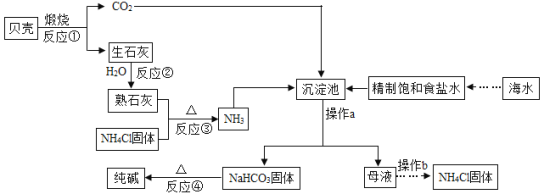
题目内容
【题目】如图1为兴趣小组的同学在实验室做将二氧化碳通入石灰水的实验及现象。
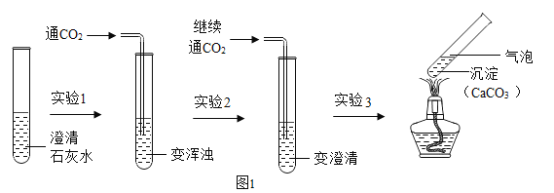
(1)实验1:发生反应的化学方程式为_____。
(2)实验2:二氧化碳、水继续与碳酸钙沉淀反应生成溶于水的Ca(HCO3)2
实验3:实验3中的化学方程式为Ca(HCO3) 2![]() CaCO3↓+H2O+CO2↑,从该实验可得出结论:CaCO3比Ca(HCO3)2热稳定性_____(选填“强”或“弱”)。
CaCO3↓+H2O+CO2↑,从该实验可得出结论:CaCO3比Ca(HCO3)2热稳定性_____(选填“强”或“弱”)。
(3)某地区硬水中溶有较多的可溶性Ca(HCO3)2、Mg(HCO3)2。
①生活中常用_____来区分硬水和软水。
②煮沸硬水可降低水的硬度,同时生成难溶性混合物固体A。
(探究实验一)上述固体A的成份是什么?
(猜想)固体A中除CaCO3外,还含有:
猜想1:只含MgCO3 猜想2:只含Mg(OH)2 猜想3:MgCO3和Mg(OH)2
(实验1)取10.0g干燥的固体A,加入足量的稀盐酸充分反应,产生4.4gCO2气体。
(结论1)
①猜想1、2错误。其中判断猜想1错误的理由是_____。
②猜想3正确,固体A中MgCO3和Mg(OH)2的质量比是_____。
(探究实验二)判断二氧化碳与氢氧化钠溶液的是否能发生反应
(1)实验a:取一充满CO2的矿泉水瓶,加入一定量的水,立即拧紧瓶盖,振荡,发现瓶子变瘪。另取一相同的充满CO2的矿泉水瓶,向其中加入与水等体积的NaOH溶液,立即拧紧瓶盖,振荡,得到溶液X,此时观察到的现象是_____。实验中,用两只矿泉水瓶做对比实验的目的是_____。此对比实验可证明CO2与NaOH溶液发生了化学反应。
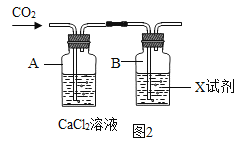
(2)实验b:如图2所示的方案中:当A中没有现象,B中出现白色浑浊,也可证明CO2和NaOH能发生反应。该装置中,则B中所加试剂X应该是_____。
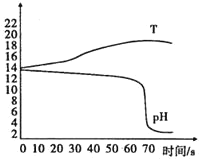
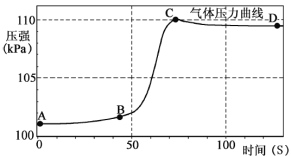
(3)实验c:将CO2持续通入一定浓度一定量的NaOH溶液中,用数字化实验技术测定反应过程中溶液的pH和温度变化情况(结果如图3、图4所示)。
资料显示:在本实验条件下,Na2CO3溶液和 NaHCO3液的pH分别为11.0和8.5。
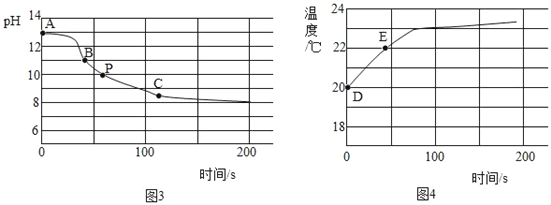
由图3可知CO2和NaOH能发生反应。
①图3中,AB段发生反应的化学方程式为_____。BC段发生反应的化学方程式为_____。P点时的溶液中的溶质为_____(写化学式)。
②图4中,DE段温度变化的原因是_____。
【答案】Ca(OH)2+CO2=CaCO3↓+H2O 强 肥皂水 只含有碳酸镁时生成二氧化碳质量大于4.4g 21:4 塑料瓶比加入水时更瘪 对照比较,证明二氧化碳与氢氧化钠溶液反应 氯化钙和氢氧化钠的混合溶液 2NaOH+CO2=Na2CO3+H2O Na2CO3+H2O+CO2=2NaHCO3 Na2CO3、NaHCO3 二氧化碳和氢氧化钠反应放热
【解析】
(1)氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,发生反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O,故填:Ca(OH)2+CO2=CaCO3↓+H2O;
(2)碳酸氢钙受热分解生成碳酸钙、水和二氧化碳,说明CaCO3比Ca(HCO3)2热稳定性强,
故填:强;
(3)①生活中常用肥皂水来区分硬水和软水,这是因为向水中加入肥皂水时,如果产生的泡沫较多,是软水,如果产生大量浮渣,是硬水,故填:肥皂水;
【探究实验一】
10g碳酸钙与稀盐酸反应生成4.4g二氧化碳,10g碳酸镁与稀盐酸反应生成二氧化碳质量大于4.4g,氢氧化镁与稀盐酸反应不生成二氧化碳;
①判断猜想1错误的理由是只含有碳酸镁时生成二氧化碳质量大于4.4g;
故填:只含有碳酸镁时生成二氧化碳质量大于4.4g。
②设10g碳酸镁和氢氧化镁的混合物反应生成4.4g二氧化碳时,碳酸镁质量为x,
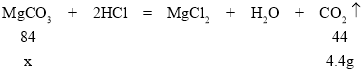
![]()
x=8.4g,
固体A中MgCO3和Mg(OH)2的质量比是:8.4g:(10g﹣8.4g)=21:4。
故填:21:4。
【探究实验二】
(1)此时观察到的现象是塑料瓶比加入水时更瘪,实验中,用两只矿泉水瓶做对比实验的目的是对照比较,证明二氧化碳与氢氧化钠溶液反应,故填:塑料瓶比加入水时更瘪;对照比较,证明二氧化碳与氢氧化钠溶液反应;
(2)该装置中,则B中所加试剂X应该是氯化钙和氢氧化钠的混合溶液,这是因为氢氧化钠和二氧化碳反应生成碳酸钠,碳酸钠和氯化钙反应生成白色沉淀碳酸钙和氯化钠,故填:氯化钙和氢氧化钠的混合溶液;
(3)①图3中,AB段氢氧化钠和二氧化碳反应生成碳酸钠和水,发生反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O,
BC段碳酸钠和水、二氧化碳反应生成碳酸氢钠,发生反应的化学方程式为:Na2CO3+H2O+CO2=2NaHCO3,
P点时的溶液中的溶质为过量的碳酸钠和反应生成的碳酸氢钠,
故填:2NaOH+CO2=Na2CO3+H2O;Na2CO3+H2O+CO2=2NaHCO3;Na2CO3、NaHCO3。
②图4中,DE段温度变化的原因是二氧化碳和氢氧化钠反应放热,故填:二氧化碳和氢氧化钠反应放热。

 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案【题目】溶液与人们的生活息息相关。
(1)以下是有关CO2气体溶解度的几组数据:
CO2在水中的溶解度(单位:mL)
压强/大气压 | 温度/℃ | ||||
0 | 25 | 50 | 75 | 100 | |
1 | 1.79 | 0.752 | 0.423 | 0.307 | 0.231 |
10 | 15.92 | 7.14 | 4.095 | 2.99 | 2.28 |
25 | 29.30 | 16.20 | 9.71 | 6.82 | 5.73 |
请根据数据
①根据CO2在水中的溶解度表,叙述外界条件是如何影响气体溶解度的?_____。
②打开可乐瓶有气体溢出,说明原瓶中的压强_____(填“大于”“小于”或“等于”)瓶外大气压强。
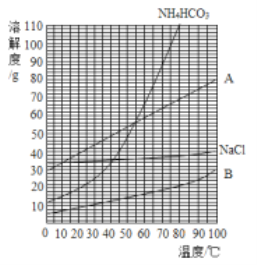
(2)以饱和NaCl溶液跟饱和NH4HCO3溶液为原料制备NaHCO3的原理为:NaCl+NH4HCO3=NaHCO3↓+NH4Cl,该反应中的四种物质的溶解度曲线如图所示。
请回答下列问题。
①35℃时,比较A、B溶解度的大小:A_____B。
②图中表示碳酸氢钠溶解度曲线的是_____(填“A”或“B”)。
③发生上述反应析出晶体后的母液是碳酸氢钠的_____(填“饱和”或“不饱和”)溶液。写出母液中所有溶质的化学式_____。
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
(演示实验)将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
(假设猜想)针对疑问,大家纷纷提出猜想.甲组同学的猜想如下,请你补上猜想四.
猜想一:只有Na2SO4; 猜想二:有Na2SO4和H2SO4; 猜想三:有Na2SO4、H2SO4和NaOH
猜想四:____
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是_____,
理由是____.
(实验探究)
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有____.
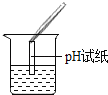
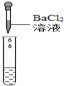
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaC12溶液,进行如下三个方案的探究.
实验方案 | 测溶液的pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
(得出结论)通过探究,全班同学一致确定猜想二是正确的。
(评价反思)老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定.同时指出(2)中存在两处明显错误,请大家反思.同学们经过反思发现了如下两处错误:
①实验操作中的错误是_____;
②实验方案中也有一个是错误的,错误的原因是_____