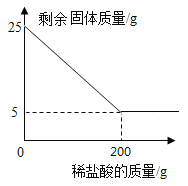
题目内容
【题目】物质的用途与其性质密切相关。
(1)铜通常用于制作导线,因为其有良好的延展性和______性。
(2)生石灰常用作食品干燥剂,其原因是(用化学方程式表示)_____。
(3)氢氧化钙常用作建筑材料,因为其吸收二氧化碳会变成坚固的_____。
(4)氢氧化镁可用于治疗胃酸(主要成分是盐酸)过多,其原因是(用化学方程式表示)_____。
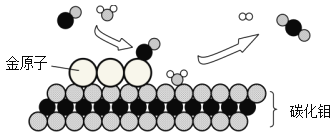
(5) 硅是信息技术的关键材料。高温下氢气与四氯化硅(SiCl4)反应可制得高纯度的硅,同时生成氯化 氢。该反应的化学方程式为_____。
【答案】导电 ![]() 碳酸钙
碳酸钙 ![]()
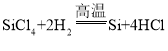
【解析】
(1)铜通常用于制作导线,因为其有良好的延展性和导电性。
(2)生石灰常用作食品干燥剂,其原因是氧化钙能与水反应生成氢氧化钙,反应的化学方程式为:![]() 。
。
(3)氢氧化钙常用作建筑材料,因为其吸收二氧化碳会变成坚固的碳酸钙。
(4)氢氧化镁可用于治疗胃酸(主要成分是盐酸)过多,其原因是氢氧化镁与盐酸反应生成氯化镁和水,反应的方程式为:![]() 。
。
(5)高温下氢气与四氯化硅(![]() )反应可制得高纯度的硅,同时生成氯化氢,该反应的化学方程式为:
)反应可制得高纯度的硅,同时生成氯化氢,该反应的化学方程式为: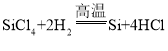 。
。

【题目】化学课上,同学们做了人体呼出的气体使澄清石灰水变浑浊的实验后,对呼出的气体中主要成分及含量非常好奇,设计实验进行探究。
(提出问题)呼出的气体中有哪些主要成分,它们的含量是多少?
(查阅资料)①呼出的气体中仍含有O2。
②CO2在饱和NaHCO3溶液中的溶解度非常小。
(猜想与实验)
猜想:呼出的气体中主要成分是N2、O2、CO2、水蒸气等。
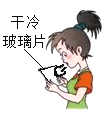
实验I:验证呼出的气体中含有水蒸气。
(1)实验操作如图所示。
(2)观察到的现象为________,根据该现象可以判断呼出的气体中含有水蒸气。
实验II:验证呼出的气体中含有N2、O2、CO2,并测定其含量。
同学们在老师的指导下设计了如下图所示装置(B是带刻度的量气装置)。
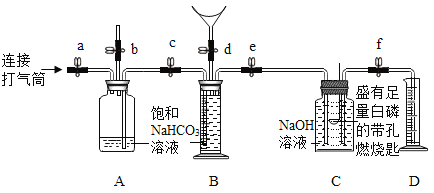
(1)实验记录
实验操作 | 主要实验现象 | 实验结论及解释 | |
① | 检查装置的气密性。 向装置中加入药品。 关闭止水夹a~f。 | 装置的气密性良好。 | |
② | 打开b、c、d,向B中吹入一定量气体后关闭d,并冷却到室温。 | B中液体进入到A中,B中液体减少500 mL。 | 收集500 mL气体。 |
③ | 关闭b,打开a、e、f,用打气筒向A中缓缓充气,直到B中气体刚好全部排出。 | ________,D中液体为475 mL。 | 反应的化学方程式为________。 |
④ | 关闭e、f,用凸透镜聚光引燃白磷。 | 白磷燃烧,产生大量白烟,放出大量热。 | 呼出的气体中含有O2。 |
⑤ | 待白磷熄灭并冷却到室温,打开f。 | ________,D中剩余液体为400 mL。 | 呼出的气体中含有N2。 |
(2)数据处理
呼出的气体中主要成分的含量
N2 | O2 | CO2 | |
体积/mL | |||
体积分数/% |
同学们经过3次重复实验,确认了呼出气体中的主要成分及其含量。
(实验反思)
(1)该实验设计依据的N2性质有 (填字母序号)。
A.难溶于水 B.不能和NaOH溶液反应
C.无色无味的气体 D.不能燃烧,也不支持燃烧
(2)实验II操作⑤中,若C中气体未完全冷却就打开f并读数,则所测O2的体积分数(填“偏小”、“不变”或“偏大”)。