题目内容
【题目】如图是a、b、c三种物质的溶解度曲线,下列分析正确的是
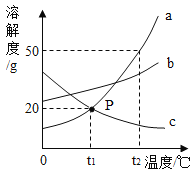
A. P点表示物质A和C的溶解度都为20g
B. 若a中混有少量b,可采用蒸发结晶法分离提纯a
C. 将t2℃时a、b、c三种物质的饱和溶液降温至t1℃时,a溶液中析出的晶体不一定最多
D. 将t1℃时a、b、c三种物质的饱和溶液升温至t2℃时,所得溶液的溶质质量分数关系是a >b >c
【答案】C
【解析】A.根据溶解度曲线的交叉点表示的意义解答;
B. 据a、b的溶解度受温度影响情况分析提纯物质的方法;
C.根据饱和溶液的质量分析解答。
D. 据三种物质的溶解度随温度变化情况及饱和溶液中溶质质量分数的计算式分析解答。
解:A. P点表示t1℃时物质a和c的溶解度都为20g。故错误;
B. 由于a、b物质的溶解度随温度的升高而增加且a物质的溶解度受温度的影响变化较大,当a物质中混有少量b物质时,可采用降温结晶的方法得到较纯净的a物质。故错误;
C. 将t2℃时a、b、c三种物质的饱和溶液降温至t1℃时,由于a、b、c三种溶液的质量不一定相等,故a溶液中析出的晶体不一定最多。正确;
D. 据图可知:a、b的溶解度随温度的升高而增大,c的溶解度随温度的升高而减小;所以将t1℃时a、b、c三种物质的饱和溶液均升温到t2℃时,a、b溶质质量不变,溶剂质量不变,溶质质量分数不变,c析出晶体,依然是饱和溶液,又t1℃时a、c的溶解度相同,此时a、c的溶质质量分数相等,而a升温后变为不饱和溶液,溶质的质量分数与升温前相等,据饱和时质量分数的计算式![]() ×100%,可知溶解度越大质量分数也就越大,t2℃时溶液中溶质质量分数最大的是b >a >c。故错误。
×100%,可知溶解度越大质量分数也就越大,t2℃时溶液中溶质质量分数最大的是b >a >c。故错误。

 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案【题目】实验室现有硫酸镁和硫酸钠的固体混合物样品,小明同学想测定样品中硫酸镁的质量分数,先称取该混合物样品20g,完全溶于100g水中。然后取用了一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:
次数 | 1 | 2 | 3 | 4 |
加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
生成沉淀的质量/g | 2.9 | X | 8.7 | 8.7 |
(1)上表中X的数值为______;原固体混合物样品中硫酸镁的质量分数是 ;
(2)求恰好完全反应时,溶液中溶质的质量分数。(结果精确到0.1%)
(3)请在下图中画出在20 g 样品中加氢氧化钠溶液的质量与产生沉淀质量变化关系的示意图。
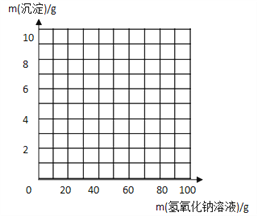
(4)若用氢氧化钡溶液代替氢氧化钠溶液来测定样品中硫酸镁的质量分数,是否可行?并说明理由。