题目内容
【题目】水和溶液在生产、生活中起着十分重要的作用,请回答下列问题。
(1)电解水的实验可以证明水的组成,该反应的化学方程式为_____。 电解水时,相同条件下,如果负极产生 15mL 气体,理论上在正极应产生_____mL 气体。
(2)氢氧化钙的溶解度随温度升高而减小。要想把一瓶接近饱和的石灰水变成饱和溶液,
具体措施有:①加入氢氧化钙;②加入氧化钙;③加入水;④蒸发水;⑤升高温度;⑥降低 温度。以上方法中,能达到目的的是_____(选填数字序号)。
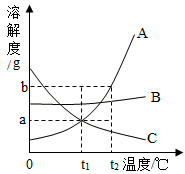
(3)向装有等量水的 A、B、C 烧杯中分别加入 10g、25g、25g NaNO3 固体,充分溶解后, 现象如图一所示。
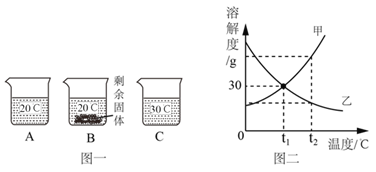
①烧杯中的溶液一定属于饱和溶液的是_____(填字母序号);
②图二中能表示 NaNO3 溶解度曲线的是_____(选填“甲”或“乙”);
③由图二分析,若分别将 100g 甲、乙的饱和溶液从 t2℃降温到 t1℃,对所得溶液的叙 述正确的是_____(填序号)。
A.甲、乙都是饱和溶液 B.溶液质量:甲<乙
C.所含溶剂质量:甲<乙 D.溶质质量分数:甲=乙
④若用溶质质量分数为 20%的 NaNO3 溶液和蒸馏水来配制 100g 溶质质量分数为 8%的NaNO3 溶液,则所需 20%的 NaNO3 溶液与蒸馏水的质量比为_____。
【答案】 2H2O 通电 2H2↑+ O2 ↑ 7.5 ①②④⑤ B 甲 BC 2:3
【解析】本题考查了水的电解实验,饱和溶液与不饱和溶液的相互转化,固体溶解度曲线应用,溶液的稀释的计算等。
(1) 水电解生成氢气和氧气,该反应的化学方程式为2H2O 通电 2H2↑+ O2 ↑; 电解水时,相同条件下,负极产生的氢气和正极产生氧气的体积比为2:1,如果负极产生 15mL 气体,理论上在正极应产生7.5mL 气体;
(2)向接近饱和的溶液中增加溶质或蒸发溶剂都可以使溶液变成饱和溶液,把一瓶接近饱和的石灰水变成饱和,可以采取:①加入氢氧化钙、④蒸发水的方法;由于氢氧化钙的溶解度随温度升高而减小,升高温度后,氢氧化钙的溶解度变小,把一瓶接近饱和的石灰水变成饱和,还可以采取⑤升高温度的方法。氧化钙与水反应生成氢氧化钙,反应过程中氢氧化钙的质量增加,水的质量减少,把一瓶接近饱和的石灰水变成饱和,还可以采取②加入氧化钙的方法。故①②④⑤符合题意;
(3)①B 中有剩余固体,则一定为饱和溶液;
②由图一后两个烧杯可知,温度上升,烧杯中固体溶解,NaNO3溶解的质量增大,因此其溶解度随温度上升而增大,甲能表示NaNO3溶解度曲线;
③A、甲的溶解度随温度降低而减小,降温后甲的溶解度降低,有溶质析出,溶液仍饱和,乙的溶解度随温度降低而增大,降温后乙的溶解度增大,溶液变成不饱和,错误;B、由于甲有晶体析出而乙没有,溶液质量是甲<乙, 正确;C、t2℃时,甲的溶解度大于乙,因此同样取 100g两者的饱和溶液,由于甲的溶质质量分数更大,甲溶液中溶质质量大于乙,甲中溶剂质量小于乙,降温后不影响溶剂质量,甲中溶剂质量小于乙,正确;D、根据 t1℃下两种物质的溶解度大小和曲线,降温后甲析出溶质,溶液仍饱和;降温后乙的溶解度增大,溶液变成不饱和,乙溶质质量分数不变,一定温度下饱和溶液的溶质质量分数=![]() ×100%,t1℃的甲的溶解度大于t2℃时乙的溶解度,所以降温后溶质质量分数:甲>乙,错误。故选BC;
×100%,t1℃的甲的溶解度大于t2℃时乙的溶解度,所以降温后溶质质量分数:甲>乙,错误。故选BC;
④需要20%的 NaNO3 溶液质量=![]() =40g,需要蒸馏水的质量=100g-40=60g,所以需要20%的NaCl溶液与蒸馏水的质量比为40g:60g=2:3。
=40g,需要蒸馏水的质量=100g-40=60g,所以需要20%的NaCl溶液与蒸馏水的质量比为40g:60g=2:3。

 53天天练系列答案
53天天练系列答案【题目】化学实验探究总是能引起同学们的兴趣。某化学兴趣小组在实验室实验时发现了一瓶标签缺损的溶液,如下图。为了确认其溶质成分,同学们进行了如下探究:
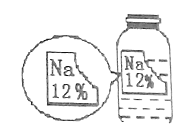
(提出猜想)猜想一:NaCl; 猜想二:Na2CO3;猜想三: NaHCO3 猜想四:NaOH
(设计实验一)
小明取少量溶液样品于试管中,用玻璃棒蘸取溶液滴在pH试纸上,读取数据,pH=9,得出结论,猜想四成立。
小王认为小明的结论不准确,理由是:________________。
从小明的实验结果中可以判断出猜想_________也一定是错误的。
(设计实验二)小红取适量稀盐酸于试管中,滴加少量此溶液,溶液中产生气泡。于是认为猜想二正确。
小王认为仍然不能确定,理由是_______________。
(查阅资料)常温下,碳酸钠和碳酸氢钠的溶解度为以下表格中的数据。
Na2CO3 | NaHCO3 | |
溶解度/g | 21.8 | 9.6 |
(分析结论)从资料显示的数据,再结合药品的标签,可以判断猜想_________不正确,理由是_____________________。
(问题交流)(1)Na2CO3和 NaHCO3在生活中被称为“苏打兄弟”,其中NaHCO3在生活中可用来_______________ (写出一条即可)。
(2)Na2CO3在空气中长期放置,会吸收空气中水蒸气和另一种气体而转变成 NaHCO3。请你写出反应方程式________________________。
[注意:若答对以下问题可奖励4分,化学试卷总分不超过60分。]
兴趣小组和老师一起继续实验,将盐酸滴加到Na2CO3溶液中进行反应,并用数字化实验装置pH传感器测定了溶液中pH的变化。采集数据得到曲线如下图所示。
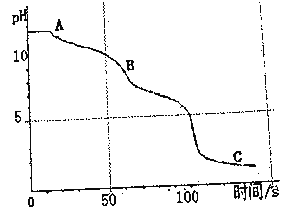
(3)0-50s时,同学们观察到溶液中并没有想象中的气泡产生,请你写出AB段发生反应的化学方程式:__________________。
(4)B点溶液pH大于7,是因为___________(填物质名称)的水溶液呈碱性。
(5)C点所得溶液的溶质是__________________。