题目内容
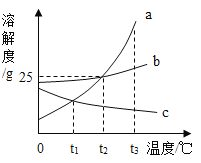
【题目】KNO3与NH4Cl的溶解度曲线如图。下列说法正确的是_____
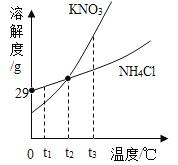
A KNO3的溶解度比NH4Cl的大
B t2℃时,两种溶液中的溶质质量相等
C t3℃时,配制等质量的KNO3与NHCl的饱和溶液,需要水的质量NH4Cl>KNO3
D两种物质的饱和溶液从t3℃降温到t1℃时,所得溶液的溶质质量分数大小关系是______
【答案】C NH4Cl>KNO3
【解析】
A、没有指明温度,无法比较KNO3与NH4Cl的溶解度大小;故选项错误;
B、t2℃时,没有指明溶液的质量分数和溶液的质量,无法比较所含溶质的质量;故选项错误;
C、t3℃时,KNO3的溶解度比NH4Cl的大,所以该温度下硝酸钾饱和溶液中溶质质量分数大于氯化铵的,因此该温度下,等质量的两种溶液中,氯化铵溶液中水的质量更多;故选项正确;
D、两种物质的饱和溶液从t3℃降温到t1℃时,所得溶液仍为饱和溶液,而t1℃时,KNO3的溶解度比NH4Cl的小,故所得溶液的质量分数也小;
故答案为:C;NH4Cl>KNO3。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】工业上冶炼金属锌主要有火法和湿法两种工艺。
(1)火法炼锌时发生如下反应:
2ZnS+3O2 2ZnO+2SO2;2C+O2
2ZnO+2SO2;2C+O2 2CO;ZnO+CO
2CO;ZnO+CO Zn+CO2。
Zn+CO2。
①化合物ZnS中Zn元素的化合价是_____,上述反应在鼓风炉中控制温度在1100℃至1300℃进行,使生成的锌气化蒸馏出来,蒸馏过程属于_____变化。
②已知反应前矿石中ZnS的质量为ag,则理论上可以生成Zn的质量为_____g(用含a的式子表示,可不化简)。
(2)湿法炼锌的原理是利用CO32-与Zn2+结合生成ZnCO3沉淀。某研究小组利用该原理,用碳酸钠作为沉淀剂,探究从含锌废水中回收锌的最佳条件,实验的数据如下:
实验编号 | 初步处理的废液用量/mL | pH值 | 反应时间/min | 沉锌率% |
a | 800 | 6 | 30 | 84.30 |
b | 800 | 7.5 | 10 | 85.27 |
c | 800 | 7.5 | 30 | 99.60 |
d | 800 | 8.0 | 30 | 99.55 |
①本实验探究了哪些因素对沉锌率的影响_____。
②已知碳酸钠溶液呈碱性。实验中碳酸钠使用量最大的是_____(填编号)。工业生产中采用实验_____(填编号)的提取条件更合理。