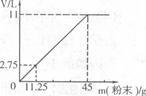
题目内容
(10宜昌28).(5分)鸡蛋壳的主要成分是碳酸钙,为了测定鸡蛋壳中碳酸钙的含量,小丽称取30g干燥的碎鸡蛋壳放入烧杯中,并向其中加入了80g稀盐酸恰好完全反应(假设鸡蛋壳中除碳酸钙外的其他成分都不溶于水,且不与稀盐酸反应),反应后烧杯中物质的总质量为101.2g。我能完成下列计算:
⑴碳酸钙的质量;
⑵当碳酸钙恰好完全反应时所得溶液中溶质的质量分数。(结果保留一位小数)
⑴碳酸钙的质量;
⑵当碳酸钙恰好完全反应时所得溶液中溶质的质量分数。(结果保留一位小数)
(5分)解:根据质量守恒定律,生成二氧化碳的质量为80g+30g-101.2g=8.8g………………1分
设30g鸡蛋壳中碳酸钙的质量为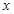 ,生成氯化钙的质量为
,生成氯化钙的质量为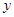 。
。
CaCO3+2HCl=CaCl2+H2O+CO2↑…………………………1分
100 111 44
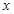
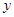 8.8g
8.8g
(1)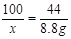
 ………………………………1分
………………………………1分
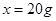
(2)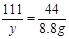

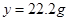
所得溶液中溶质的质量分数=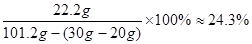 …… 1分
…… 1分
答:⑴30g鸡蛋壳中碳酸钙的质量为20g。⑵所得溶液中溶质的质量分数为24.3%。
(解、设、答不全扣1分,三项不另设分数。)
设30g鸡蛋壳中碳酸钙的质量为
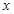 ,生成氯化钙的质量为
,生成氯化钙的质量为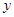 。
。CaCO3+2HCl=CaCl2+H2O+CO2↑…………………………1分
100 111 44
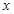
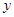 8.8g
8.8g(1)
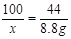
 ………………………………1分
………………………………1分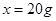
|
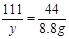

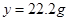
所得溶液中溶质的质量分数=
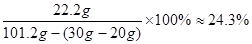 …… 1分
…… 1分答:⑴30g鸡蛋壳中碳酸钙的质量为20g。⑵所得溶液中溶质的质量分数为24.3%。
(解、设、答不全扣1分,三项不另设分数。)
略

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目