题目内容
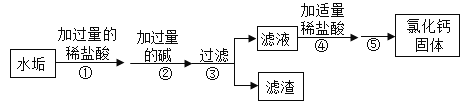
【题目】粗盐中除了含有泥沙等难溶性物质外,还含有可溶性杂质Na2SO4、MgCl2和CaCl2为了除去其中的可溶性杂质,某化学兴趣小组设计了如图实验过程。
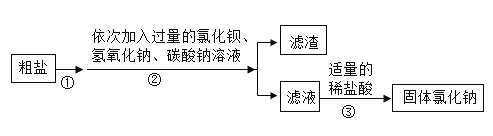
(1)①②③操作中都要用到的一种玻璃仪器是_______________。
(2)Na2CO3需要在BaCl2之后加入,为什么?_________
(3)最终得到的氯化钠固体与粗盐中含有的氯化钠相比,质量增加,请写出导致这一变化的化学方程式。(写出一个)_________
【答案】玻璃棒 除去过量的氯化钡 ![]() (答案不唯一)
(答案不唯一)
【解析】
根据流程图分析粗盐中可溶性杂质的除去过程,先将粗盐溶解,因此操作①是溶解,再依次加入过量的BaCl2、NaOH、Na2CO3,依次除去杂质Na2SO4、MgCl2、CaCl2以及过量的BaCl2,发生的反应:![]() 、
、![]() 、
、![]() 、
、![]() ,根据分别得到滤渣和滤液知操作②是过滤,得到滤渣是硫酸钡、氢氧化镁、碳酸钙和碳酸钡,得到的滤液中含有氯化钠、过量的氢氧化钠和碳酸钠,再加入适量的稀盐酸,除去过量的氢氧化钠和碳酸钠,发生的化学方程式:
,根据分别得到滤渣和滤液知操作②是过滤,得到滤渣是硫酸钡、氢氧化镁、碳酸钙和碳酸钡,得到的滤液中含有氯化钠、过量的氢氧化钠和碳酸钠,再加入适量的稀盐酸,除去过量的氢氧化钠和碳酸钠,发生的化学方程式:![]() 、
、![]() ,根据之后得到的固体氯化钠知,操作③是蒸发,蒸发的过程中,过量的稀盐酸挥发,最终得到纯净的氯化钠固体。
,根据之后得到的固体氯化钠知,操作③是蒸发,蒸发的过程中,过量的稀盐酸挥发,最终得到纯净的氯化钠固体。
(1)操作①是溶解,操作②是过滤,操作③是蒸发,都用到的玻璃仪器是玻璃棒,故填:玻璃棒。
(2)碳酸钠可以与氯化钡反应生成碳酸钡沉淀和氯化钠,因此碳酸钠加在氯化钡之后,可以除去过量的氯化钡,故填:除去过量的氯化钡。
(3)除去杂质Na2SO4、MgCl2和CaCl2以及过量的BaCl2、NaOH、Na2CO3的过程中,每一个反应都有新的氯化钠生成,因此最终得到的氯化钠质量增加,故填:![]() (答案不唯一)。
(答案不唯一)。

【题目】某化学小组同学利用盐酸和氧化铜进行实验的过程中,出现了意想不到的现象:发现溶液变为了绿色。为探究溶液变绿的原因,进行系列实验。
(查阅资料)①氧化铜(CuO)为黑色固体②铜离子(Cu2+)在水溶液中呈蓝色
(进行实验)
实验1:取2mL不同浓度的盐酸分别加入到盛有0.2g氧化铜的试管中,进行实验。
序号 | 浓盐酸与水的体积比 | 现象 |
1-1 | 1:1 | 30秒后溶液变为绿色,无黑色固体剩余 |
1-2 | 1:2 | 1分钟后溶液变为蓝绿色,无黑色固体剩余 |
1-3 | 1:3 | 2分钟后溶液变为蓝色,无黑色固体剩余 |
1-4 | 1:4 | 4分钟后溶液变为浅蓝色,有黑色固体剩余且不再减少 |
实验2:取2mL稀盐酸(浓盐酸与水的体积比为1:3)加入到盛有0.2g氧化铜的试管中,实验装置如下。
序号 | 2-1 | 2-2 |
操作 |
|
|
现象 | 2分钟后溶液变为蓝色,无黑色固体剩余 | 10秒后溶液变为浅绿色,无黑色固体剩余 |
(解释与结论)
(1)补全氧化铜与盐酸反应的化学方程式:![]() _____
_____
(2)实验1中配制不同浓度的盐酸时,需要使用的仪器包括_____(填序号,下同)。
A 量筒
B 烧杯
C 玻璃棒
D 酒精灯
(3)实验1的目的是_____。
(4)结合实验1和实验2,得出的结论是_____。
(反思与评价)
(5)实验1-4中,“有黑色固体剩余”的原因是_____。
(6)实验1中若进行浓盐酸与水的体积比为1:5的实验,充分反应后可能出现的现象为_____。
A 溶液变为绿色,无黑色固体剩余
B 溶液变为更浅的蓝色,有黑色固体剩余
C 溶液变为更浅的蓝色,无黑色固体剩余