题目内容
称取氯化钠和氯化钙的固体混合物14 g,放入烧杯中,加入96 g碳酸钠溶液恰好完全反应(反应的方程式为Na2CO3+CaCl2===CaCO3↓+2NaCl)。待反应完全后过滤,称得滤液的总质量为100 g。
(1)根据质量守恒定律,可知生成沉淀的质量为___________________________。
(2)固体混合物中氯化钙的质量是多少?
(3)所得滤液中溶质的质量分数是多少?
(1)根据质量守恒定律,可知生成沉淀的质量为___________________________。
(2)固体混合物中氯化钙的质量是多少?
(3)所得滤液中溶质的质量分数是多少?
(1)10g (2)11.1g (3) 14.6%
试题分析:(1) 根据质量守恒定律可知,反应前物质质量总和=反应后物质质量总和,即反应前所有混合物的总质量=滤液的总质量+生成沉淀的质量,所以生成沉淀的质量=14g+96g-100g=10g。
(2)根据化学方程式中各物质之间的质量比,利用碳酸钙沉淀的质量,列出比例式,即可计算出固体混合物中氯化钙的质量。
解,设固体混合物中含氯化钙的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl
111 100
x? 10g
 =
=
解得,x="11.1g"
答:原固体混合物中氯化钙的质量为11.1g。
(3) 根据题意,反应完全后过滤,所得滤液为氯化钠溶液,滤液中的溶质NaCl包括混合物中原有的NaCl和反应生成的NaCl;根据上述方程式可以求出生成NaCl的质量,而混合物中原有的NaCl的质量=混合物总质量-氯化钙的质量,据此可以计算出滤液中溶质的质量,然后根据溶质质量分数=
 ×100%计算即可。
×100%计算即可。解,设反应后生成氯化钠的质量为y。
Na2CO3+CaCl2===CaCO3↓+2NaCl
100 117
10g y
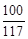 =
=
解得,y=11.7g
原混合物中含氯化钠的质量=14g-11.1g=2.9g
则所得滤液中溶质的质量分数=
 ×100%="14.6%"
×100%="14.6%" 答:所得滤液中溶质的质量分数为14.6%。
点评:此题是关于化学方程式及溶质质量分数的计算题,要求学生有较强的数据分析能力,解题的关键是根据质量守恒定律判断出沉淀碳酸钙的质量,然后依据已知量对未知的应求量进行求解计算即可;特别要注意的是,反应后的溶液的溶质氯化钠包含两部分:即反应生成的氯化钠和原固体混合物中的氯化钠。

练习册系列答案
相关题目

 CH3OH当消耗5.6kgCO时,计算生成甲醇的质量。
CH3OH当消耗5.6kgCO时,计算生成甲醇的质量。 
