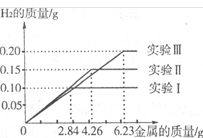
题目内容
某厂生产的纯碱包装袋上标有Na2CO3 90%字样(杂质为NaCl)。为判断该纯碱是否合格,取12g样品放入烧杯中,加入100g稀盐酸,恰好完全反应。反应后所得溶液质量为107.6 g(产生的气体全部逸出,且知:Na2CO3 +2HCl=2NaCl+CO2↑+H2O)。
试计算:(写出计算过程)
(1)反应生成二氧化碳的质量;
(2)所用稀盐酸中溶质的质量分数;
(3)判断该纯碱产品是否合格。
试计算:(写出计算过程)
(1)反应生成二氧化碳的质量;
(2)所用稀盐酸中溶质的质量分数;
(3)判断该纯碱产品是否合格。
(1)4.4(2分)(2)7.3%(2分)(3)88.3%< 90%,不合格
试题分析:(1)反应生成二氧化碳的质量即为反应后装置减少的质量:12g+100g-107.6 g=4.4g;
设反应消耗的HCl质量为
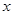 g,消耗的Na2CO3质量为
g,消耗的Na2CO3质量为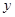 g。
g。Na2CO3 +2HCl=2NaCl+CO2↑+H2O
106 73 44
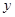
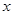 4.4g
4.4g
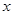 =10.6g
=10.6g 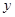 =7.3g
=7.3g(2)所用稀盐酸中溶质的质量分数为:
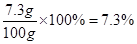
(3)该纯碱产品实际碳酸钠含量:
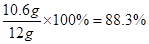
88.3%< 90%,所以该纯碱产品不合格。
点评:化学方程式的计算属于中考重点要求掌握的内容,每年必考,最后一道压轴题中一定会是这种题型,考生要多练多总结。

练习册系列答案
相关题目
 Na2CO3+H2O+CO2↑.现取NaHCO316.8g,在敞口容器中加热到质量不再改变为止,减少的质量为( )
Na2CO3+H2O+CO2↑.现取NaHCO316.8g,在敞口容器中加热到质量不再改变为止,减少的质量为( )