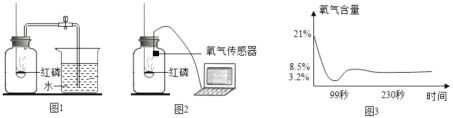
题目内容
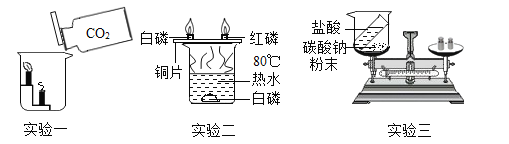
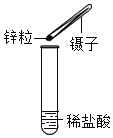
【题目】为探究盐酸的化学性质,某化学小组做了如下实验:
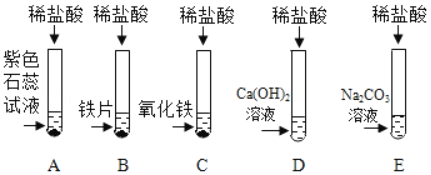
(1)A试管中的实验现象为_____,C试管中所发生反应的化学方程式为_____。
(2)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。
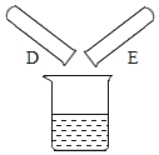
(提出问题)滤液中溶质的成分是什么?
(作出猜想)猜想:NaCl
猜想二:NaCl和CaCl2
猜想三:_____
猜想四:NaCl、Ca(OH)2和HCl
(进行讨论)经过讨论,同学们一致认为猜想_____是错误的。
(设计实验)请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量的碳酸钠溶液。 | _____ | 猜想二不成立 |
取少量滤液于试管中,滴加_____(填名称)。 | _____ | 猜想三成立 |
(迁移拓展)稀盐酸、稀硫酸有一些相似的化学性质,是因为在不同的酸溶液中都含有_____。
【答案】紫色石蕊溶液变红 Fe2O3+6HCl=2FeCl3+3H2O NaCl和Na2CO3 四 无沉淀产生(或无明显变化) 稀盐酸(或稀硫酸)(合理即可) 产生气泡(合理即可) 氢离子(或H+)
【解析】
(1)盐酸呈酸性,紫色石蕊溶液遇酸性溶液变红色,A试管中的实验现象为:紫色石蕊溶液变红;C试管中氧化铁和盐酸反应生成氯化铁和水,反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;
(2)作出猜想:
试管D中,稀盐酸和氢氧化钙反应生成氯化钙和水,反应的化学方程式为:Ca(OH)2+2HCl═CaCl2+2H2O;试管E中,稀盐酸和碳酸钠反应生成氯化钠、二氧化碳和水,反应的化学方程式为Na2CO3+2HCl==2NaCl+H2O+CO2↑;把反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成,这说明D中盐酸剩余,E试管中碳酸钠溶液过量,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,反应的溶液中一定存在氯化钠,可能存在过量的碳酸钠或氯化钙。因此:
猜想一:NaCl,猜想二:NaCl和CaCl2,猜想三:NaCl和Na2CO3,猜想四:NaCl、Ca(OH)2和HCl;
进行讨论:经过讨论,同学们一致认为猜想四是错误的,因为氢氧化钙和盐酸不能共存;
设计实验:
若猜想二不成立,说明溶液中不存在氯化钙,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,所以实验现象为:无沉淀产生(或无明显变化);
若猜想三成立,说明溶液中存在碳酸钠,碳酸钠与稀盐酸(或稀硫酸)反应生成氯化钠(或硫酸钠)、水和二氧化碳。取少量滤液于试管中,滴加稀盐酸(或稀硫酸),产生气泡,猜想三成立;
迁移拓展:稀盐酸、稀硫酸有一些相似的化学性质,是因为在不同的酸溶液中都含有氢离子(或H+)。

【题目】在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如表所示,下列说法不正确的是( )
物质 | X | Y | Z | W |
反应前质量/g | 10 | 3 | 90 | 0 |
反应后质量/g | 3.2 | 3 | 待测 | 3.2 |
A. W可能是单质 B. Y可能是催化剂
C. 该反应是分解反应 D. 反应后Z物质的质量为![]()