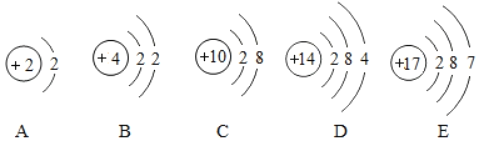
题目内容
【题目】某同学称取100g烧碱固体样品(样品中的杂质是碳酸钠),加水溶解得到溶液A,取A溶液的1/5向其中加入CaCl2溶液。反应时CaCl2溶液与沉淀的质量关系如图所示。

(1)样品中氢氧化钠的质量为_____g;
(2)计算所加CaCl2溶液中溶质的质量分数____。(写出计算过程)
【答案】73.5g 11.1%
【解析】
解:烧碱是氢氧化钠的俗称,氢氧化钠与氯化钙不反应,碳酸钠与氯化钙反应生成碳酸钙沉淀,设20g 样品中碳酸钠的质量为x,所加CaCl2溶液中溶质的质量y。
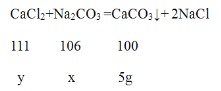
![]() =
=![]() =
=![]()
解得x=5.3g,y=5.55g,所加CaCl2溶液中溶质的质量分数为:![]() ×100%=11.1% 由于样品配成溶液后取其中的
×100%=11.1% 由于样品配成溶液后取其中的![]() ,可以理解为后续实验所用的药品为20g。则样品中氢氧化的质量为(20g﹣5.3g)×5=73.5g
,可以理解为后续实验所用的药品为20g。则样品中氢氧化的质量为(20g﹣5.3g)×5=73.5g
答:(1)样品中氢氧化钠的质量为 73.5g;
(2)所加CaCl2溶液中溶质的质量分数为11.1%。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目