题目内容
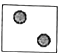
【题目】据《自然》杂质报道,科学家最近研制出一种以元素Sr的原子做钟摆的钟是世界上最精确的钟。元素Sr形成的粒子结构示意图如图所示。
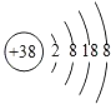
(1)Sr属于_____(填“金属”或“非金属”或“稀有气体”)元素。Sr元素位于元素周期表中的第_____周期
(2)如图所表示的粒子的化学符号是_____
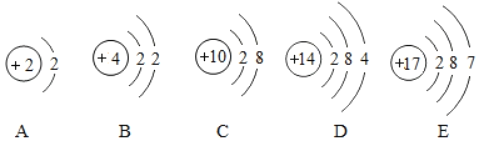
(3)图表示的微粒中,具有相对稳定结构的是_____(填序号,下同),与Sr化学性质相似的是_____
【答案】金属 5 Sr2+ AC B
【解析】
(1)由元素Sr形成的粒子结构示意图可知,元素Sr的原子的外层电子数是38﹣2﹣8﹣18﹣8=2<4,为金属元素,核外电子有5层,属于第5周期;
(2)由元素Sr形成的粒子结构示意图可知,该微粒是带两个正电荷的阳离子,符号为:Sr2+;
(3)由于图2的最外层的电子数可知,A只有一个电子层,该层上有2个电子,C的最外层有8个电子。都属于稳定结构。最外层电子数决定元素的化学性质,最外层电子数相同的元素,化学性质相似。由于元素Sr的原子的外层电子数是2,B原子的最外层也有2个电子,具有相似的化学性质。
故答案为:(1)金属;5;(2)Sr2+;(3)AC;B。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案【题目】 某小组同学做“硫在氧气中燃烧”的实验时,老师建议在集气瓶底部放少量NaOH溶液吸收生成的SO2.这种做法引起了同学们的思考:SO2与NaOH是否发生反应。
[查阅资料]通常状况下,1体积水约能溶解40体积SO2。
[实验方案]同学们向充满SO2的软塑料瓶中迅速倒入一定量NaOH溶液,拧紧瓶盖,振荡,发现塑料瓶变瘪,他们认为SO2与NaOH发生了反应。
[反思与改进]甲同学认为上述实验不够严谨,理由是_____。于是同学们设计了如下两个改进方案。
方案一
实验操作 | 实验现象 |
向两个充满SO2的200mL软塑料瓶中分别注入 10mL水和NaOH溶液,振荡,对比。 | 两个瓶子变瘪的程度完全相同 |
乙同学认为由于两个瓶子变瘪的程度完全相同,因此无法证明SO2与NaOH是否发生了反应。试分析导致两个瓶子变瘪的程度完全相同的原因是_____。他认为若改变注入水和NaOH溶液的体积便可达到实验目的,注入液体的体积可以是_____(填序号)。
a.15mL b.8mL c.5mL d.3mL
方案二
实验操作 | 实验现象 |
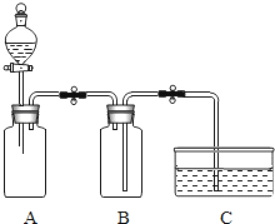
利用右图所示装置进行实验:
向两个充满SO2的300mL集气瓶中分别加入6mL水和NaOH溶液,一段时间后,打开止水夹,对比。 | 倒吸入两个集气瓶中的液体体积完全相同 |
丙同学认为上述方案也无法证明SO2与NaOH是否发生反应。你认为导致吸入液体的体积完全相同的原因是_____。
丁同学思考后,将上述装置进行了改进,便达到实验目的。改进装置如图所示,你认为装置B的作用是_____。