题目内容
实验小组欲证明氧化铜能加快氯酸钾的分解,他们进行了如下实验:
①称取xg胆矾晶体,研细后加入10mL蒸馏水溶解;
②将足量的NaOH溶液与上述溶液充分反应,生成蓝色沉淀,过滤后洗涤沉淀;
③将所得沉淀转移到坩埚中,均匀缓慢加热至完全变为黑色,研细备用;
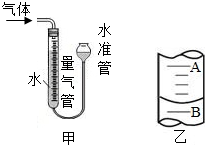
④按下表中的质量混合好固体后,在相同条件下加热,并与MnO2的催化效果做比较,实验时间均以生成50mL气体为准(见图甲),其他可能影响实验的因素均忽略.
回答下列问题:
(1)步骤①中的x应至少称取______g(结果保留1位小数),上述实验步骤中需要使用玻璃棒的是______(填序号).
(2)表格中的“待测数据”是指______.
(3)为了较准确地测量气体体积,在读取反应前后量气管中液面的读数的过程中,应注意______(填字母编号).
a.视线与凹液面最低处相平b.读数前不能移动量气管和水准管
c.保持水准管静止,待水准管中液面不再上升时,立刻读数
d.读数前应上下移动水准管,待两管液面相平再读数
(4)若50mL量气管中液面的位置如图乙所示,A与B刻度间相差1mL,刻度A为20,则此时气体的读数为______.
(5)如果要进一步探究CuO在反应中是否起到催化作用,请完成下列表格后续实验.(提示:可从催化剂的概念完成实验.)

①称取xg胆矾晶体,研细后加入10mL蒸馏水溶解;
②将足量的NaOH溶液与上述溶液充分反应,生成蓝色沉淀,过滤后洗涤沉淀;
③将所得沉淀转移到坩埚中,均匀缓慢加热至完全变为黑色,研细备用;
④按下表中的质量混合好固体后,在相同条件下加热,并与MnO2的催化效果做比较,实验时间均以生成50mL气体为准(见图甲),其他可能影响实验的因素均忽略.
| 编号 | KClO3质量(g) | 其他物质质量(g) | 待测数据 |
| 1 | 2.0 | / | |
| 2 | 2.0 | CuO0.5 | |
| 3 | 2.0 | MnO20.5 |
(1)步骤①中的x应至少称取______g(结果保留1位小数),上述实验步骤中需要使用玻璃棒的是______(填序号).
(2)表格中的“待测数据”是指______.
(3)为了较准确地测量气体体积,在读取反应前后量气管中液面的读数的过程中,应注意______(填字母编号).
a.视线与凹液面最低处相平b.读数前不能移动量气管和水准管
c.保持水准管静止,待水准管中液面不再上升时,立刻读数
d.读数前应上下移动水准管,待两管液面相平再读数
(4)若50mL量气管中液面的位置如图乙所示,A与B刻度间相差1mL,刻度A为20,则此时气体的读数为______.
(5)如果要进一步探究CuO在反应中是否起到催化作用,请完成下列表格后续实验.(提示:可从催化剂的概念完成实验.)
| 实验步骤 | 设计这一步骤的目的 |
| 实验表明,加入CuO后产生O2的速率比未加入时快得多 | CuO能加快KClO3的分解 |
(1)设需要胆矾的质量为x
CuSO4?5H2O~CuO
250 80
x 0.5g
=
x=1.6g
由于①②③步中有溶解,过滤,转移固体等操作,所以都要用的是玻璃棒.
(2)本题的目的是验证氧化铜的催化作用,关键是测定反应时间,所以表格中的“待测数据”就是测定反应时间,
(3)为了较准确地测量气体体积,在读取反应前后量气管中液面的读数的过程中,视线与凹液面最低处相平,读数前应上下移动水准管,待两管液面相平再读数.
(4)注意量气管的刻度是上面小,下面大,所以读数应是20.8mL.
(5)如果要进一步探究CuO在反应中是否起到催化作用,要从催化剂的特点入手,通过实验来验证反应前后催化剂的质量和化学性质都不改变.
答案为:(1)1.6;①②③
(2)生成50mL气体所需时间
(3)ad
(4)20.8mL
(5)
CuSO4?5H2O~CuO
250 80
x 0.5g
| 250 |
| x |
| 80 |
| 0.5g |
x=1.6g
由于①②③步中有溶解,过滤,转移固体等操作,所以都要用的是玻璃棒.
(2)本题的目的是验证氧化铜的催化作用,关键是测定反应时间,所以表格中的“待测数据”就是测定反应时间,
(3)为了较准确地测量气体体积,在读取反应前后量气管中液面的读数的过程中,视线与凹液面最低处相平,读数前应上下移动水准管,待两管液面相平再读数.
(4)注意量气管的刻度是上面小,下面大,所以读数应是20.8mL.
(5)如果要进一步探究CuO在反应中是否起到催化作用,要从催化剂的特点入手,通过实验来验证反应前后催化剂的质量和化学性质都不改变.
答案为:(1)1.6;①②③
(2)生成50mL气体所需时间
(3)ad
(4)20.8mL
(5)
| 实验步骤 | 设计这一步骤的目的 |
| 将加热后残留的固体溶于足量的水,过滤后称重CuO的质量 | CuO的质量在反应前后是否保持不变 |
| 将过滤后的CuO重新与KClO3混合加热,观察是否依旧能加快KClO3的分解 | CuO的化学性质在反应前后是否保持不变 |

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目








