题目内容
现用如实验装置测定铜和氧化铜混合物中铜元素的含量.
试回答下列问题:
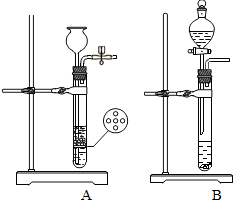
(1)仪器a、b的名称为a______,b______;
(2)A中可观察到的现象为______;反应的化学方程式为______;
(3)B装置的作用是______;C装置的作用是______;
(4)在给D装置加热前,应该进行的一步操作是______,其目的是______;
(5)已知D装置中铜和氧化铜混合物的质量为10g,经称量,反应前后E装置的质量分别为100.2g和102.0g,原混合物中铜元素的质量分数为______(假设各装置中的反应或吸收都是完全的).
(6)F装置的作用是吸收空气中的水蒸气,如不加F装置,会使实验结果______(填“偏低”或“偏高”).

试回答下列问题:
(1)仪器a、b的名称为a______,b______;
(2)A中可观察到的现象为______;反应的化学方程式为______;
(3)B装置的作用是______;C装置的作用是______;
(4)在给D装置加热前,应该进行的一步操作是______,其目的是______;
(5)已知D装置中铜和氧化铜混合物的质量为10g,经称量,反应前后E装置的质量分别为100.2g和102.0g,原混合物中铜元素的质量分数为______(假设各装置中的反应或吸收都是完全的).
(6)F装置的作用是吸收空气中的水蒸气,如不加F装置,会使实验结果______(填“偏低”或“偏高”).
(1)仪器a、b的名称为:a为长颈漏斗;b为酒精灯;
(2)锌和盐酸生成氯化锌和氢气,A中可观察到的现象为Zn粒逐渐减少,且有气泡产生;反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑;
(3)盐酸具有挥发性,挥发出氯化氢气体,氢氧化钠和氯化氢反应生成氯化钠和水,所以B装置的作用是除去氢气中的HCl;浓硫酸具有吸水性,C装置的作用是除去氢气中水蒸气;
(4)氢气是可燃性气体,给D装置加热前,应该进行的一步操作是先通入H2;其目的是赶走管中的空气,防止加热时爆炸;
(5)E装置增加的质量为水的质量,水的质量=102.0g-100.2g=1.8g
设参加反应的氧化铜的质量为x.
CuO+H2
Cu+H2O
80 18
x 1.8g
=
x=8.0g
氧化铜中铜元素的质量为:8.0g×
×100%=6.4g
原混合物中铜元素的质量分数=
×100%=84%
答:原混合物中铜元素的质量分数为84%.
(6)如不加F装置会使得空气中水蒸气进入使得水的质量增加,那么计算出的氧化铜的质量也随着增加,所以会使实验结果偏小.
故答案为:(1)长颈漏斗;酒精灯;(2)Zn粒逐渐减少,且有气泡产生;Zn+2HCl═ZnCl2+H2↑;
(3)除去氢气中的HCl;除去氢气中水蒸气;(4)先通入H2;赶走管中的空气防止加热时爆炸;(5)84%;(6)偏低;
(2)锌和盐酸生成氯化锌和氢气,A中可观察到的现象为Zn粒逐渐减少,且有气泡产生;反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑;
(3)盐酸具有挥发性,挥发出氯化氢气体,氢氧化钠和氯化氢反应生成氯化钠和水,所以B装置的作用是除去氢气中的HCl;浓硫酸具有吸水性,C装置的作用是除去氢气中水蒸气;
(4)氢气是可燃性气体,给D装置加热前,应该进行的一步操作是先通入H2;其目的是赶走管中的空气,防止加热时爆炸;
(5)E装置增加的质量为水的质量,水的质量=102.0g-100.2g=1.8g
设参加反应的氧化铜的质量为x.
CuO+H2
| ||
80 18
x 1.8g
| 80 |
| x |
| 18 |
| 1.8g |
x=8.0g
氧化铜中铜元素的质量为:8.0g×
| 64 |
| 64+16 |
原混合物中铜元素的质量分数=
| 10.0g-8.0g+6.4g |
| 10.0g |
答:原混合物中铜元素的质量分数为84%.
(6)如不加F装置会使得空气中水蒸气进入使得水的质量增加,那么计算出的氧化铜的质量也随着增加,所以会使实验结果偏小.
故答案为:(1)长颈漏斗;酒精灯;(2)Zn粒逐渐减少,且有气泡产生;Zn+2HCl═ZnCl2+H2↑;
(3)除去氢气中的HCl;除去氢气中水蒸气;(4)先通入H2;赶走管中的空气防止加热时爆炸;(5)84%;(6)偏低;

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目