题目内容
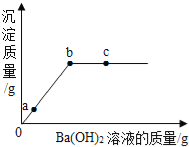
【题目】将10.0%的NaOH溶液逐滴加入到50 g稀盐酸中,得到混合液的温度与加入NaOH溶液的质量关系如图。下列说法正确的是
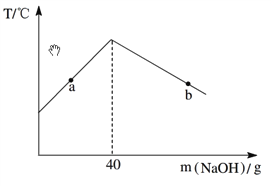
A. a点时的混合液能与Fe发生置换反应
B. b点时的混合液能与Mg(NO3)2发生两种复分解反应
C. 加入40 g NaOH溶液时混合液pH>7
D. 稀盐酸中HCl的质量分数为3.65%
【答案】A
【解析】A、酸碱中和反应放热,所以反应中溶液的温度逐渐升高,反应结束后由于散热,温度又逐渐降低,因此可知加入氢氧化钠溶液的质量为40g时,刚好完全反应,则a点盐酸有剩余,所以a点时的混合液能与Fe发生置换反应;B 、由上述分析可知,b点时氢氧化钠溶液过量,溶质为氯化钠和氢氧化钠,混合液中氢氧化钠能与Mg(NO3)2发生两种复分解反应生成氢氧化镁沉淀和硝酸钠;C. 加入40 g NaOH溶液时刚好完全反应,所以混合液pH=7;D、刚好完全反应,消耗氢氧化钠的质量为40g×10.0%=4g;设稀盐酸中HCl的质量为x
NaOH + HCl= NaCl+H2O
40 36.5
4g x
40/4g=36.5g/x x=3.65g
稀盐酸中HCl的质量分数为3.65÷50g=7.3% 选A

 培优口算题卡系列答案
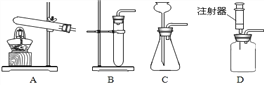
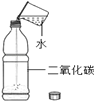
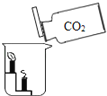
培优口算题卡系列答案【题目】下列实验设计不能达到目的是( )
选项 | A | B | C | D |
实验设计 |
|
|
|
|
实验目的 | 证明二氧化碳能溶于水 | 证明二氧化碳密度大于空气 | 证明通入的气体是二氧化碳 | 小苏打能与盐酸反应放出CO2 |
A. A B. B C. C D. D
【题目】某研究性学习小组对炭粉与氧化铜反应产物中气体的成分进行研究。
【提出假设】该反应的气体产物中有二氧化碳和其他气体。
【查阅资料】氮气不能跟炭粉和氧化铜发生反应,也不跟石灰水反应,可用来隔绝氧气。
【设计方案】将一定量氧化铜在隔绝氧气的条件下与过量炭粉充分反应。通过测定反应前后相关物质的质量进行判断。
【进行实验】
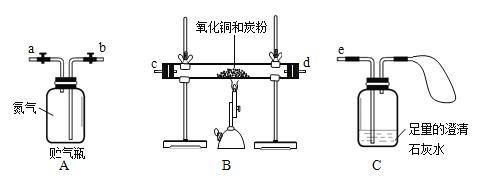
操作步骤 | 实验现象及分析 |
取1.6 g氧化铜与1 g炭粉均匀混合,放入质量为48.2 g的B装置的玻璃管中。 | |
打开弹簧夹,往贮气瓶A中注入水,将氮气通入B装置中。 | ①水应从_______端注入(填“a”或“b”)。 |
先通一段时间氮气。 | ②目的是_____________。 |
夹紧弹簧夹,用酒精喷灯加热玻璃管内的混合物。 | ③玻璃管中的现象是______________。 |
停止加热,再通入一段时间氮气。 | ④目的是________________。 |
实验完毕后,冷却装置至室温,称得B玻璃管及固体总质量为50.2 g,称得C瓶中液体增重0.4 g。 | ⑤结论:原假设_____(填“成立”或“不成立”),理由是____________(用计算式表示)。 |