题目内容
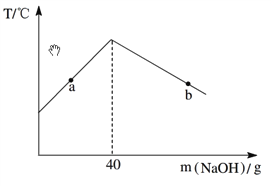
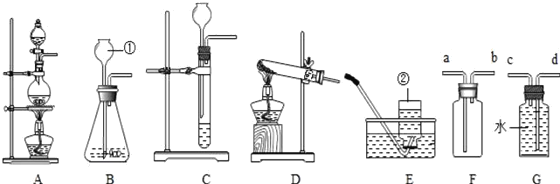
【题目】如图所示为实验室中常见的气体制备、干燥、收集和性质实验的部分仪器(组装实验装置时,可重复选择仪器).试根据题目要求,回答下列问题:Ⅰ.以石灰石和稀盐酸为原料,在实验室中制备并收集干燥、纯净的二氧化碳气体,按照要求设计实验装置、连接仪器,并检验装置的气密性.

(1)所选仪器的连接顺序为______(从左到右填写仪器序号字母)(提示:挥发出的少量HCl气体可用饱和碳酸氢钠溶液吸收).
(2)用石灰石和稀盐酸制取二氧化碳的化学方程式为______.
(3)若将二氧化碳气体通入紫色石蕊试液中,试液显______色.
Ⅱ.小强同学欲用锌和稀硫酸反应制取氢气,然后利用氢气测定某氧化铁样品中Fe2O3的质量分数.若测得装置C的质量增加2.7g,则氧化铁样品中含有Fe2O3的质量为______g.
(4)若不连接装置D,用上述方法计算处氧化铁样品的纯度将会偏大,若通过___________方法,即使不连接装置D,计算出氧化铁样品的纯度也会基本一致.
【答案】 ADCF CaCO3+2HCl=CaCl2+H2O+CO2↑ 红 8 通过测定玻璃管内固体减少的质量来计算混合物中氧化铁的质量
【解析】(1)实验室制取CO2在常温下,用大理石和盐酸反应,不需要加热。要收集一瓶干燥、纯净的二氧化碳气体,就要把杂质氯化氢气体和水蒸气除去,氯化氢气体用饱和碳酸氢钠溶液除去,水蒸气用浓硫酸除去;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集,所以所选仪器的连接顺序为ADCF;
(2)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)二氧化碳和水反应生成碳酸,碳酸能使紫色石蕊试液变红色;
Ⅱ、设混合物中氧化铁的质量为x
Fe2O3+H2![]() 2Fe+3H2O
2Fe+3H2O
160 54
x 2.7g
![]()
x=8g;
(4)玻璃管固体减少的质量就是氧化铁中氧元素的质量,然后依据氧化铁中氧元素的质量分数,所以可以通过测定玻璃管内固体减少的质量来计算混合物中氧化铁的质量。

【题目】我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献。其生产工艺流程示意图如下:
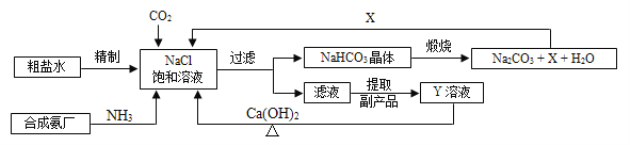
(1)粗盐水中主要含有Ca2+、Mg2+、SO42-等杂质离子,工业上常用加入稍过量的① NaOH溶液、② Na2CO3溶液、③ BaCl2溶液及适量的盐酸等除杂、精制。则加入试剂合理的顺序为_____________(填字母序号)。
A.①②③ B.③②① C.①③②
(2)加盐酸的作用是(用方程式表示)________________、______________。
(3)制碱原理可看作是由① CO2 + NH3 + H2O = NH4HCO3和② NaCl + NH4HCO3 = NaHCO3+ NH4Cl两个反应加合而成。反应②为复分解反应,请根据复分解反应发生的条件及表1中相关物质20℃时的溶解度,分析反应②为何能顺利进行?_______________。
表1 相关物质的溶解度(20℃)(单位:g)
NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
36.0 | 21.7 | 9.6 | 37.2 |
(4)操作2为洗涤、煅烧。晶体应在以下装置______________中(填字母序号)进行“洗涤”操作。

在上述操作中,如何判断晶体已经洗涤干净______________。
(5)X的化学式为_____________,若X直接排放到空气中会造成的后果是_______________。
(6)Y是滤液中最主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,该产物的名称为______________,Y的化学式为______________,写出Y的一种用途_____________。