题目内容
【题目】实验是化学研究的基本方法,请回答下列与实验有关的问题。
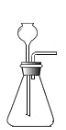
![]()
注 射 器
实验一 实验二 实验三 实验四
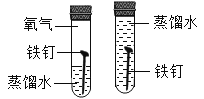
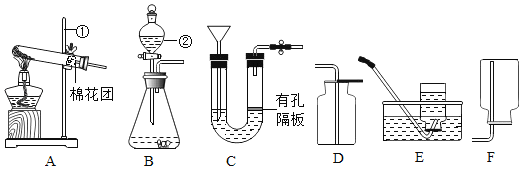
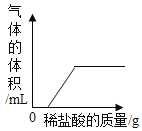
(1)实验一中,把水注入锥形瓶中至封住长颈漏斗下端管口,将注射器与右侧导管连接,往外拉动注射 器的活塞,观察到_____现象,说明装置气密性良好;
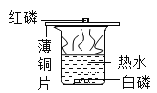
(2)实验二用于探究燃烧的条件,其中烧杯内水的作用是:_____(任写一种);
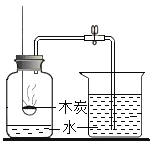
(3)实验三是实验室模拟工业炼铁装置,请写出硬质玻璃管中(Fe2O3)发生反应的化学方程式_____;
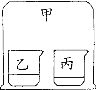
(4)实验四:若图中的两个气球能悬浮在空气中,则气体甲可能是_____(填序号)。
A 空气 B 氧气 C 氢气
【答案】气泡产生 隔绝空气 Fe2O3+3CO![]() 2Fe+3CO2 C
2Fe+3CO2 C
【解析】
(1)利用装置内外的气压差检验装置的气密性,所以装入药品前,可用注射器检查装置气密性,方法如下:从长颈漏斗加水至没过漏斗下端,将注射器与右侧管相连,缓慢拉动注射器活塞,瓶内的气压降低,若观察到漏斗的下端有气泡产生现象,说明装置气密性良好;
(2)该实验烧杯中的水除了使温度达到白磷的着火点外还有一个作用是隔绝空气;
(3)一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(4)二氧化碳的密度大于空气,若要图中的两个气球悬浮在空气中,则气体甲密度比空气小,氧气的密度大于空气,氢气的密度小于空气,故选C;

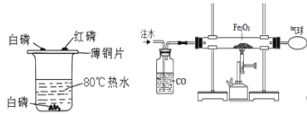
【题目】小明同学对家中久置的袋装固体食品防腐剂的成分产生了兴趣(品名和成分如图所示),于是和同学一起,设计实验进行探究:

[提出问题]久置固体食品防腐剂的成分是什么?
[查阅资料]铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
[作出猜想]久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3 。
[实验探究]甲同学的探究方案如下表:
实验操作 | 实验现象 | 实验结论 |
(1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红。 | 固体中一定含有_______和氢氧化钙。此过程的化学方程式_______。 |
(2)另取少量固体放于试管中,滴加足量的稀盐酸 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液。 | 固体中一定含有Fe ,一定不含 Fe2O3 |
(3)将步骤(2)中产生的气体通入到澄清的石灰水中 | ________ | 固体中一定含有CaCO3 |
[交流与反思]
(1)“504双吸剂”中的铁粉可以吸收空气中的_______、______。
(2)实验操作(2)的实验现象里“有大量无色气体产生”, 根据甲同学的整体探究方案推测,无色气体的成分是一定含有______,可能含有________。
(3)乙同学认为甲同学的实验中不能得出一定含Ca(OH)2的结论,理由是______。
(4)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是_______。
【题目】兴趣小组的同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质利用数字化传感器测得烧杯中溶液pH的变化图象进行相关探究。
(提出问题)它们溶液的酸碱性及与酸反应时溶液的pH如何变化?
(实验探究1)向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称 | 蒸馏水 | 碳酸氢钠溶液(A) | 碳酸钠溶液(B) | 氢氧化钠溶液(C) |
紫甘蓝汁液显示的颜色 | 蓝紫色 | 蓝色 | 绿色 | 黄色 |
查阅资料:
pH | 7.5~9 | 10~11.9 | 12~14 |
紫甘蓝汁液显示的颜色 | 蓝色 | 绿色 | 黄色 |
(得出结论1)三种溶液的碱性由强到弱的顺序为______。(用A、B、C表示)
(实验探究2)甲同学在烧杯溶液中加入约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液由_____色变为____色。向其中加入稀盐酸,该反应的化学方程式为______。
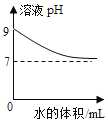
乙同学向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如下图所示.
(得出结论2)①从微观角度分析,该反应的实质是____。
②如图所示,下列说法正确的是(___________)
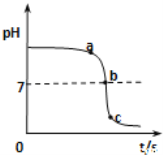
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是只有NaCl
C.该实验是将氢氧化钠溶液逐滴滴入到盛有盐酸的烧杯中
D.由a点到b点的pH变化过程证明酸和碱发生了中和反应