题目内容
广东省某工业园区里合理处理和回收利用工业废水,某种工业废水中含有大量的硫酸亚铁,少量的银离子以及污泥.如图是该废水处理厂回收回收银和硫酸亚铁晶体的流程示意图.请回答下列问题:
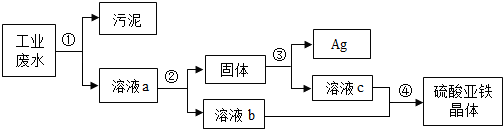
(1)实验室常用 的方法分离污泥和溶液a,该操作需要使用的玻璃仪器有 ;
(2)步骤②中需加入过量的物质是 ,加入该物质过量的目的是 ;
(3)步骤③中需加入适量的 ,再过滤,则发生反应的化学方程式是 ;
(4)步骤④的操作是 ,将溶液b和溶液c相要混合,其优点是 .

(1)实验室常用
(2)步骤②中需加入过量的物质是
(3)步骤③中需加入适量的
(4)步骤④的操作是
考点:金属的化学性质,过滤的原理、方法及其应用,蒸发与蒸馏操作,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:过滤分离不溶性固体与液体,将废水中的污泥与溶液用过滤法分离,得溶液1中含有硫酸铜和硫酸亚铁,加入过量的铁将硫酸铜中的铜全部置换出来,过滤得到铜和铁的混合物和滤液硫酸亚铁,然后在固体混合物中加入适量硫酸与铁反应生成硫酸亚铁溶液,最后将硫酸亚铁溶液冷却结晶即得硫酸亚铁晶体.
解答:解:
(1)步骤①是将污泥与溶液分离,故可用过滤,过滤操作中用到的玻璃仪器是烧杯、漏斗、玻璃棒;
(2)要将硫酸铜与硫酸亚铁的混合溶液中回收铜,同时得到硫酸亚铁溶液,只能加入过量的铁置换硫酸铜溶液中的铜;不能加入其它活泼金属,否则引入新的金属离子;加入该物质过量的目的是将废水中银离子全部置换出来加以回收;
(3)铁与硫酸铜反应生成铜和硫酸亚铁,因此经过步骤②之后得到的固体中含有生成的铜和剩余的铁,加入适量稀硫酸为了除去过量的铁粉,稀硫酸与铁反应生成硫酸亚铁;再过滤,则发生反应的化学方程式是Fe+H2SO4=FeSO4+H2↑;
(4)步骤④的操作是蒸发,将溶液b和溶液c相要混合,其优点是可获得两个步骤的硫酸亚铁,将其综合利用.
故答案为:
(1)过滤; 烧杯、漏斗和玻璃棒等;(2)Fe(或铁) 将废水中银离子全部置换出来加以回收;(3)稀硫酸Fe+H2SO4=FeSO4+H2↑;(4)蒸发; 可获得两个步骤的硫酸亚铁,将其综合利用(其他合理答案也可)
(1)步骤①是将污泥与溶液分离,故可用过滤,过滤操作中用到的玻璃仪器是烧杯、漏斗、玻璃棒;
(2)要将硫酸铜与硫酸亚铁的混合溶液中回收铜,同时得到硫酸亚铁溶液,只能加入过量的铁置换硫酸铜溶液中的铜;不能加入其它活泼金属,否则引入新的金属离子;加入该物质过量的目的是将废水中银离子全部置换出来加以回收;
(3)铁与硫酸铜反应生成铜和硫酸亚铁,因此经过步骤②之后得到的固体中含有生成的铜和剩余的铁,加入适量稀硫酸为了除去过量的铁粉,稀硫酸与铁反应生成硫酸亚铁;再过滤,则发生反应的化学方程式是Fe+H2SO4=FeSO4+H2↑;
(4)步骤④的操作是蒸发,将溶液b和溶液c相要混合,其优点是可获得两个步骤的硫酸亚铁,将其综合利用.
故答案为:
(1)过滤; 烧杯、漏斗和玻璃棒等;(2)Fe(或铁) 将废水中银离子全部置换出来加以回收;(3)稀硫酸Fe+H2SO4=FeSO4+H2↑;(4)蒸发; 可获得两个步骤的硫酸亚铁,将其综合利用(其他合理答案也可)
点评:从废水中回收金属一般步骤先加入一种廉价金属置换出另一种金属,然后过滤,将过量金属除去即可.

练习册系列答案
相关题目