题目内容
【题目】煤是社会生产、生活中最重要的能源,工业上常把煤进行气化和液化处理,使煤变成清洁能源。煤气化和液化流程示意图如下图所示,请结合图像回答问题:
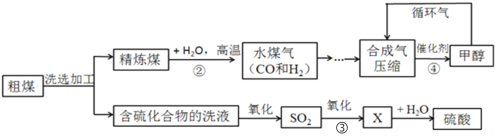
(1)精炼煤中主要成分是碳,步骤②中发生反应的化学方程式为__________。
(2)步骤③中,SO2进一步氧化得到X,X为硫的另一种氧化物,其中硫元素的化合价为+6价,X的化学式为________。
(3)经过进一步净化,含较多杂质的水煤气转化为合成气(CO和H2的混合气体),步骤④中生成的甲醇(CH3OH)是一种重要的化工原料,该反应的化学方程式为_________,该反应的基本类型是 _________。
(4)循环气的主要成分是__________和少量未完全分离出去的甲醇。
(5)从“绿色化学”的角度分析,“煤的气化和液化”流程的优点:_________。
【答案】C + H2O ![]() CO + H2 SO3 CO + 2H2
CO + H2 SO3 CO + 2H2 ![]() CH3OH 化合反应 CO、H2 原料全部转化为产品或实现“零排放”,不对环境造成污染 (从绿色化学角度) 。
CH3OH 化合反应 CO、H2 原料全部转化为产品或实现“零排放”,不对环境造成污染 (从绿色化学角度) 。
【解析】
(1)碳和水在高温的条件下反应生成一氧化碳和氢气,故反应的化学方程式写为:C + H2O ![]() CO + H2。
CO + H2。
(2)设这种硫的氧化物的化学式为SxOy,硫元素的化合价为+6价,氧元素的化合价为-2价,化合物在各元素的化合价的代数和为零,则x×(+6)+(-2)×y=2,x:y=1:3,所以该氧化物的化学式为SO3,故填SO3。
(3)该反应是一氧化碳和氢气在催化剂的条件下反应生成甲醇,故反应的化学方程式写为:. CO + 2H2 ![]() CH3OH;
CH3OH;
由化学方程式可知,该反应是两种物质反应生成一种物质,属于化合反应,故填化合反应。(4)由题干可知:循环气的主要成分与合成气的成分是相同的,为一氧化碳和氢气,故填CO、H2。
(5)由图可知,从“绿色化学”的角度分析,该流程的优点是原料全部转化为了产品,没有产生污染物,故填原料全部转化为产品或实现“零排放”,不对环境造成污染。

 名校课堂系列答案
名校课堂系列答案【题目】(1)黄铜是___________(填“Cu-Ag”或“Cu-Zn”)的合金。
(2)小桦和小杰对黄铜的成分产生兴趣,他俩决定对黄铜中的铜元素含量进行测定探究:
小桦称取10g黄铜样品,量取60g质量分数为14.6%的稀盐酸平均分成六等份,分别加入到盛有黄铜的烧杯中,当小杰观察到无气泡冒出时记录了以下表格数据:
次数 | 1 | 2 | 3 | 4 | 5 | 6 |
加稀盐酸质量(g) | 10 | 20 | 30 | 40 | 50 | 60 |
烧杯中固体质量(g) | 8.7 | 7.4 | 6.1 | 4.8 | 3.5 | 3.5 |
请回答下列问题:
①当反应到无气泡冒出时,所消耗的稀盐酸是____________g。
②生成氢气为多少_______ g?(写出计算过程)
③黄铜中铜元素的质量分数是_________________。
④画出黄铜的质量随加入稀盐酸的变化关系图:____________