题目内容
如图为用镀锌铁片制成的日常用品。镀锌铁是指通过镀锌工艺在铁皮上进行镀锌而制成的一种产品,热镀锌产品广泛用于建筑、家电、车船、容器制造业、机电业等,几乎涉及到衣食住行各个领域。
为测定铁片镀锌层的厚度实验过程如下。
【实验步骤】
(1)剪取一片镀锌铁片,量得长度=2.0cm,宽度=1.9cm。
(2)用电子天平称量质量0.857g。
(3)实验中需要溶质质量分数为10%的稀盐酸200mL(密度=1.05g/mL),需要量取溶质质量分数为37%的浓盐酸(密度=1.18g/mL) mL(保留至小数点后1位),然后稀释。
(4)将镀锌铁片放入溶质质量分数为10%盐酸中。当观察到 ,可以判断镀锌层恰好反应。
⑸ 将溶液中的铁片取出清洗、擦干、烘干后用电子天平称量质量0.837g。
【计算结果】
(1)铁片镀锌层的质量有 g。
(2)已知锌的密度7.1g/cm3,计算出铁片镀锌层厚度mm(保留至小数点后2位)。
【实验反思】
实际计算结果偏大,同学们分析,这是因为很难通过观察现象判断镀锌层恰好反应,造成镀锌铁片浸泡在盐酸中时间 。(填“偏长”、“偏短”)
【实验改进】
资料卡片:如图1所示,两种金属活动性不同的金属放入酸碱盐溶液中,会有电子的流动,从而产生电流。
将上述实验改进成如图2的装置,当观察到 ,此时锌层恰好反应。
【实验步骤】48.1mL(1分) 气泡产生的速率突然减慢(1分)
【计算结果】(1)0.02g(1分)(2)0.37mm(2分)
【实验反思】偏长(1分)
【实验改进】电流计指针指向“0” (1分)
解析试题分析:【实验步骤】(3)溶液稀释前后,溶质质量不变:
设需取用37%(ρ=1.18g/cm3)的盐酸的体积为x
10%×200mL×1.05g/mL=37%×1.18g/mLx
x≈48.1mL;
(4)当锌镀层完全反应后就是铁与盐酸反应,由于锌和铁的活泼性不同,反应速率就不同,可观察到产生气泡的速率明显下降;当反应速率明显降低时,可说明镀锌铁皮表面锌恰好反应;
【计算结果】(1)铁片镀锌层的质量=原镀锌铁片的质量-烘干后铁片的质量:0.857g-0.837g=0.02g;
(2)根据题意可知锌的质量为0.02g,锌的密度为7.1g/cm3;锌层厚度= =
=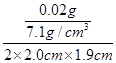 ≈0.037cm=0.37mm;
≈0.037cm=0.37mm;
【实验反思】铁也会与盐酸反应产生氢气,因此很难判断什么时候锌正好反应掉而铁没有反应;当镀锌铁片浸泡在盐酸中时间过长时,锌反应完毕,铁就会与盐酸反应,所以经过称量得到锌的质量偏大;
【实验改进】所以
【实验改进】用铁、锌作电极,稀盐酸作电解质溶液设计原电池,锌的金属性比铁强,会有电子的流动,从而产生电流.锌作负极,铁作正极,电子从负极沿导线流向正极.当反应停止时,电子停止流动,电流为0,锌恰好反应.
考点:实验探究物质的组成成分以及含量;金属的化学性质

 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案(8分)旺旺雪饼的包装袋内,放有一袋白色固体,上面写着“干燥剂、主要成分为生石灰”。同学们对在空气中放置一段时间的干燥剂进行了探究,根据生石灰的性质变化,设计了下列实验。
【实验操作1】下面是小昊同学设计的探究白色固体组成的实验方案,请你和他一起完成实验报告。
| 实验操作 | 实验现象 | 实验结论 |
| A.将样品研碎放入水中,充分搅拌,静置。 | 底部有大量白色不溶物出现 | 白色固体中含有碳酸钙 |
| B.取上层清液,滴加无色酚酞试液。 | 溶液变为 | 白色固体中含有氢氧化钙 |
B是因为(用方程式表示) 。
【实验操作2】小宇同学新设计的探究白色固体组成的实验方案,请你和他一起完成实验报告。
| 实验操作 | 实验现象 | 实验结论 |
| 1.取样品放入盛有水的试管中,用温度计测量水温先后的情况 | 温度升高 | |
| 2.取样品放入研钵,与硝酸铵一起碾磨 | | 白色固体中含有氢氧化钙 |
| 3.取样滴加稀盐酸 | 有气泡产生 | |
由小宇实验2(样品与硝酸铵一起碾磨)知道施用铵态氮肥时应注意 。
(8分)制作馒头时常加入泡打粉,在制作过程中由于产生二氧化碳气体,使馒头变得松软可口。小明对泡打粉的发面原理产生兴趣,进行了以下实验探究。
【查阅资料】
泡打粉是一种复合膨松剂,又称为发泡粉,可作为快速发面剂用于制作面食。某种泡打粉的主要成分是小苏打粉和酒石酸氢钾。
【提出问题】泡打粉为什么会产生二氧化碳气体?
【猜想】
猜想1:小苏打受热分解产生二氧化碳气体
猜想2:酒石酸氢钾受热分解产生二氧化碳气体
猜想3:小苏打和酒石酸氢钾在溶液中发生反应,产生二氧化碳气体
【实验探究】 小明利用以下实验装置进行探究
装置1 装置2
| 序号 | 实验方案 | 实验现象 | 实验结论 |
| Ⅰ | 在装置1的a试管中放入小苏打,加热 | a试管口内壁有无色液滴,_________。 | b试管中发生反应的化学方程式为______。 猜想1正确 |
| Ⅱ | 在装置1的a试管中放入酒石酸氢钾,加热 | a试管口内壁有无色液滴,石灰水不变浑浊 | ______________ |
| Ⅲ | 在装置2的c试管中放入小苏打和酒石酸氢钾的混合物,滴加________。 | , 石灰水变浑浊 | 猜想3正确 |
(1)通过以上实验探究,小明又查阅到碳酸氢钠分解的反应为: 2NaHCO3
 Na2CO3 + H2O + CO2↑,根据以上实验结论和所学知识,小明对探究问题又提出了第4个猜想,并在以上实验的基础上,利用装置2完成实验验证,其实验方案为____。
Na2CO3 + H2O + CO2↑,根据以上实验结论和所学知识,小明对探究问题又提出了第4个猜想,并在以上实验的基础上,利用装置2完成实验验证,其实验方案为____。(2)通过以上实验探究,下列关于泡打粉的说法中,正确的是_______.
A.泡打粉保存时要注意防潮
B.使用泡打粉前不需要将面进行发酵
C.用纯碱替代泡打粉能起到完全相同的效果
D.泡打粉在加水揉面与蒸馒头的过程中均能起到发面作用
有一瓶久置的氢氧化钠溶液。
(1)氢氧化钠溶液露置于空气中容易变质,请写出相关反应的化学方程式: 。
变质后的产物俗称为 。
(2)取少量该溶液于试管中,向溶液中滴加无色酚酞试液,试液变红色,由此 (填 “能”或“不能”)得出氢氧化钠溶液变质。请说明判断的理由 。
(3)为探究氢氧化钠溶液是全部变质还是部分变质,设计如下表实验:
[提供信息]:a.在水中的溶解性:Ba(OH)2可溶、Ca(OH)2微溶、BaCO3难溶;
b.BaCl2溶液、Ba(NO3)2溶液、CaCl2溶液、Ca(NO3)2溶液、NaNO3溶液均显中性。
| 实验步骤 | 实验现象 | 实验结论 |
| Ⅰ.取少量该溶液于试管中,向溶液中滴加过量的 溶液,并不断振荡。 | 有 生成。 | 说明原溶液中一定有碳酸钠。 |
| Ⅱ.取步骤Ⅰ试管中的少量上层清液,滴加酚酞溶液。 | 溶液变红色。 | 说明原溶液中一定有 。 |
由以上实验可知,氢氧化钠溶液 (填“部分”或“全部”)变质。
学习了氢氧化钠的性质之后,知道氢氧化钠溶液中含有H2O、Na+、OH-,能使无色酚酞试液变红色,某科技小组想进一步探究是哪一种粒子使无色酚酞试液变红色。
【提出猜想】猜想①:可能是H2O ;猜想②:可能是Na+;猜想③:可能是OH-。
【实验验证】
| 实验操作 | 实验现象 | 结 论 |
| ①用试管取少量蒸馏水,滴入1滴~2滴无色酚酞试液,振荡 | 试管内溶液仍为无色 | 水分子不能使无色酚酞试液变红色 |
| ②用试管取少量氯化钠溶液,滴入1滴~2滴无色酚酞试液,振荡 | | |
| ③用试管取少量氢氧化钠溶液,滴入1滴~2滴无色酚酞试液,振荡 | | |
【讨论反思】有同学认为猜想①不需要实验验证就可以排除,你认为该同学的理由是 。
下图装置可以完成多个简单实验,具有药品用量少、实验现象明显、尾气不外逸等优点。
小资料:Na2CO3 + H2SO4=Na2SO4 + H2O + CO2↑;
氧化钙(俗称生石灰)与水反应放热。
(1)若甲中吸有浓氨水,乙中吸有无色酚酞溶液,将甲、乙中的液体同时挤出,一段时间后,观察到无色酚酞溶液变红,说明分子具有的性质是________。
(2)若甲中吸有水,乙中吸有稀硫酸,烧杯①中盛有用石蕊溶液染成紫色的干燥纸花,烧杯②中盛有碳酸钠粉末。为了验证使石蕊变色的物质是碳酸而不是二氧化碳,应采取的实验操作是________。
(3)若先将甲中的液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中的液体挤出,气球又明显鼓起。请将下表中的试剂补充完整。
| | 滴管甲 | 烧杯① | 滴管乙 | 烧杯② |
| 试剂 | H2O | | | MnO2 |
气球鼓起是因为装置内气压增大,两次气压增大的原因依次是________。

