题目内容
下图装置可以完成多个简单实验,具有药品用量少、实验现象明显、尾气不外逸等优点。
小资料:Na2CO3 + H2SO4=Na2SO4 + H2O + CO2↑;
氧化钙(俗称生石灰)与水反应放热。
(1)若甲中吸有浓氨水,乙中吸有无色酚酞溶液,将甲、乙中的液体同时挤出,一段时间后,观察到无色酚酞溶液变红,说明分子具有的性质是________。
(2)若甲中吸有水,乙中吸有稀硫酸,烧杯①中盛有用石蕊溶液染成紫色的干燥纸花,烧杯②中盛有碳酸钠粉末。为了验证使石蕊变色的物质是碳酸而不是二氧化碳,应采取的实验操作是________。
(3)若先将甲中的液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中的液体挤出,气球又明显鼓起。请将下表中的试剂补充完整。
| | 滴管甲 | 烧杯① | 滴管乙 | 烧杯② |
| 试剂 | H2O | | | MnO2 |
气球鼓起是因为装置内气压增大,两次气压增大的原因依次是________。
(1)总在不断运动
(2)先将乙中的液体挤出,一段时间后,再将甲中的液体挤出
(3)烧杯①:CaO;滴管乙:过氧化氢溶液
固体CaO 与H2O反应,放出大量热,导致气压增大;H2O2和MnO2反应,产生O2并放出热量,导致气压增大(2分)
解析试题分析:(1)胶头滴管甲和乙中的液体分别滴入烧杯①和烧杯②中,二者没有直接接触。变色是因为:浓氨水中的易挥发性,有NH3分子从浓氨水中逃逸出来,进入了酚酞中使得酚酞变红;这说明了分子是在不断运动的。
(2)为了验证使石蕊变色的物质是碳酸而不是二氧化碳,可先让石蕊接触二氧化碳气体,即先将乙中的液体挤出(稀硫酸和碳酸钠反应生成二氧化碳气体)。会观察到纸花不变色,说明二氧化碳不能使石蕊变色。过一段时间后,再将甲中的液体挤出,二氧化碳气体会和水反应生成碳酸,会使纸花变色。
(3)先将甲中的液体挤出,观察到气球明显鼓起,一段时间后恢复原状;这说明甲中的液体与烧杯①中的物质接触后并没有生成气体(如生成气体,一段时间后气球不会恢复原状),即二者应该会放出热量。烧杯①中的物质可选用小资料当中提到的氧化钙。也可以选择其他能和水接触放热的物质,如氢氧化钠固体或浓硫酸。 后来再将乙中的液体挤出,气球又明显鼓起。结合烧杯②中的物质为MnO2可知乙中的液体应为过氧化氢溶,它与MnO2接触后会生成氧气且反应放出热量,造成气球内的气压明显变大,所以气球又明显鼓起。
考点:常见物质间的反应

假日里,同学们在帮忙老师整理实验室时,发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末。为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(1)对白色粉末成分的猜想和成因分析
| 白色粉末的成分 | 形 成 的 原 因 |
| 可能是CaCO3 | 石灰水与空气中CO2反应,化学方程式为: |
| 可能是 | 暑假气温较高,溶质的溶解度降低或溶剂蒸发,石灰水中的溶质析出 |
经过反复思考,同学们认为白色粉末还可能是 的混合物。
(2)设计实验:甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解,于是他得出粉末中一定有CaCO3的结论。乙同学查阅了溶解性表(如下图),认为甲同学的结论不严密,理由是 。
| | OH- | Cl- | CO32- | NO3- |
| Ca2+ | 微 | 溶 | 不 | 溶 |
为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
| 实 验 步 骤 | 可能观察到的现象 | 结 论 |
| 取上述试管中的上层清液,滴加1~2滴无色酚酞试液 | | 白色粉末中含有Ca(OH)2 |
| 往上述试管内残留的固体中加入足量稀盐酸 | 固体溶解,产生气泡 | 白色粉末中 |
| 由上述实验可知白色粉末的成分是: | ||
(3)交流与反思
通过上述实验的探究,同学们向实验室提出保存、使用易变质的溶液时的下列建议,合理的是_______(填序号)。
A.密封保存 B.使用前,临时配制 C.禁止使用这种试剂
麦兰花学名叫香雪兰,花开时节香味醉人。小红家里的阳台上种植了一盆麦兰花,她发现爸爸把草木灰洒在麦兰花盆里,麦兰花长得特别旺盛,她想知道草木灰的主要成分是什么?于是,她取一些草木灰带回学校进行了实验探究。
【提出问题】草木灰的主要成分是什么?
【查阅资料】 小红经查阅资料得知:草木灰的主要成分是一种含钾离子的盐,易溶于水。
【进行猜想】 草木灰的主要成分(1)可能是硝酸钾;(2)可能是碳酸钾。
【实验用品】草木灰、蒸馏水、稀盐酸、澄清石灰水、烧杯、漏斗、试管、橡皮塞、导气管等。
【设计实验方案】请你针对猜想设计实验方案,并进行实验。
| 实 验 步 骤 | 实 验 现 象 | 实 验 结 论 |
| (1)取一定量的草木灰于烧杯中,加入适量蒸馏水,搅拌,然后进行 操作。 | 得到无色溶液 | |
| (2)取少量无色溶液于试管中,然后滴加几滴酚酞试液 | 溶液变红色 | 溶液显 性。 |
| (3)取少量无色溶液于试管中,然后加入少量 ; 。 | 有 产生; 澄清石灰水 | 有 生成, 草木灰的主要成分是碳酸钾,猜想(2)成立 |
【实验反思】(1)写出上述实验中有关反应的化学方程式是:① ;② 。
(2)草木灰的主要成分是碳酸钾,它能否与铵态氮肥混合使用? ;原因是 。
新课标化学教材九年级上册(2012教育部审定)“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
【提出问题】氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
【实验探究】
| 实验步骤 | 实验现象 |
| Ⅰ.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
| Ⅲ.将实验Ⅱ中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 | |
| Ⅳ分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 | |
【实验结论】
(1)A中产生的气体是 ;
(2)实验Ⅱ、Ⅲ证明:氧化铁的 和 在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的化学方程式 。
【实验评价】
实验设计Ⅳ的目的是 ;
若实验Ⅳ观察到D试管中产生气泡的速率更快,由此你可以得到的结论是 。
【实验拓展】
查阅资料得知,CuO、CuSO4、、、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂。
下列有关催化剂的说法中正确的是 。
MnO2只能作过氧化氢溶液分解的催化剂
同一个化学反应可以有多种催化剂
催化剂只能加快化学反应的速率
用作催化剂的物质不可能是其他反应的反应物或生成物
酶是一种重要的生物催化剂,它属于糖类
【拓展计算】如果需制备氧气9.6克,至少需要5%过氧化氢 克。
酸、碱、盐是几类有广泛用途的重要化合物.
(1)酸和碱在组成和性质方面有很多共同的特点,请任写出其中的一条.
(2)氢氧化钙是一种常见的碱,列举其在生产、生活中的一种用途.
(3)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如右图)的溶液,他们对此产生了兴趣.
提出问题:这瓶溶液究竟是什么?
经过询问实验老师平时的药品保管得知,这瓶无色溶液应该是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中的某一种.为了确定该药品,他们首先进行了理论分析:
①小明根据标签上的组成元素认为一定不可能是 (提示:只有其中一种).
②小英提出,碳酸氢钠、硝酸钠也不可能,你认为她的依据是:
设计实验:为了确定该溶液究竟是剩余两种盐的哪一种,他们设计了如下实验.
| 实验操作 | 实验现象 |
| 取少量样品于试管中,慢慢滴加BaCl2溶液 | 出现白色沉淀 |
| 静置一段时间后,倾去上层清液,向沉淀中滴加稀盐酸 | 白色沉淀全部溶解,并产生大量气泡 |
实验反思:④小强认为上述设计实验还可简化,也能达到目的.小强的实验操作是:
(4)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数.

老师请化学兴趣小组的同学帮助他将失去标签的碳酸钠、稀盐酸、氯化钠、氢氧化钠和氯化钙溶液鉴别出来.重新贴好标签.为了区分这五种溶液,将试剂瓶编号为A,B,C,D,E,该小组同学进行了如下探究:
| | 实验步骤 | 实验现象 | 实验结论 |
| 步骤一 | 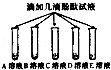 | B,C溶液呈现红色 A,D,E溶液颜色无明显变化 | B,C溶液显 性 |
| 步骤二 | 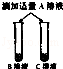 | B,C溶液红色均消失, 且C溶液中产生大量气泡 | 可确定B为 溶液;A与C的反应通常 不用作实验室制取气体的 原因是 |
| 步骤三 |  | E中无明显现象, D中的现象为 | 确定E为氯化钠溶液, 则D溶液与所加试剂发生反应的化学方程式为 |




