题目内容
【题目】人类的生产生活离不开金属,金属材料在生活各处运用很广泛
(1)金属大规模被使用的先后顺序跟____________(填序号)选项关系最大;
①地壳中金属元素的含量;②金属的导电性;③金属的活动性.
(2)铝制品具有很好的抗腐蚀性能,请用化学方程式解释_____________________;
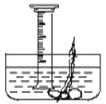
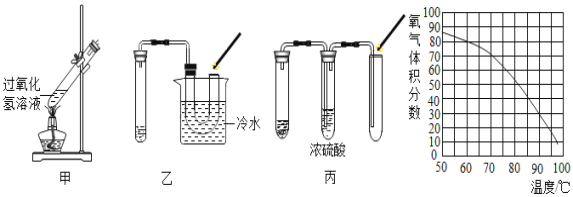
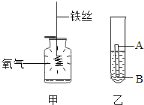
(3)图甲中发生反应后能生成____________色固体,做该实验时,在集气瓶中预先加入少量水可以防止________________________;
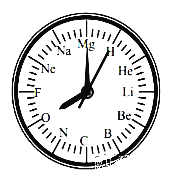
(4)小伟同学想通过一个实验(如图乙)来证明锌和铁的活动性顺序,若图乙中A为金属锌,你认为B是________溶液.发生该反应的化学方程式是__________________________;
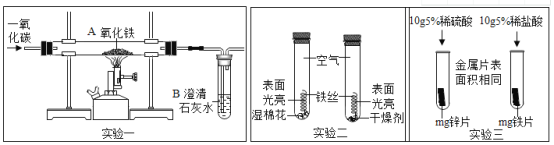
但是在实验三中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是_________________;
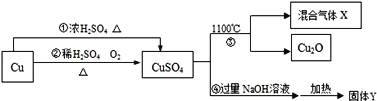
(5)(1)实验一中A处发生反应的化学方程式为___________;该实验设计的不足之处是______;
(6)根据实验二的方案设计,可以得出铁生锈的条件之一是 ______。
【答案】③ 4Al+3O2=2Al2O3 黑 集气瓶底炸裂 FeSO4 Zn+FeSO4=Fe+ZnSO4 酸的种类不同 3CO+Fe2O3 ![]() 2Fe+3CO2 缺少尾气处理 铁生锈需要水
2Fe+3CO2 缺少尾气处理 铁生锈需要水
【解析】
(1)三种金属被发现使用的先后顺序铜、铁、铝,而三种金属活动性强弱顺序为铝>铁>铜,可见,金属大规模被使用的先后顺序跟金属的活动性有关;
(2)铝和空气中的氧气反应生成致密的氧化铝薄膜,反应的化学方程为:4Al+3O2=2Al2O3;
(3)根据铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体四氧化三铁,做该实验时,在集气瓶中预先加入少量水可以防止生成物溶化后溅落下来炸裂瓶底;
(4)根据金属活动顺序,位于前面的金属能把位于后面的金属从它们的化合物溶液里置换出来,B是FeSO4溶液;该反应的化学方程式是:Zn+FeSO4=Fe+ZnSO4;金属的颗粒大小不同,酸的种类、浓度不同与酸的反应速度也不同,所以没控制相同的条件,因为选取的酸种类不同,金属表面产生气泡的快慢,也会受到影响;
(5)A处是在高温的条件下,一氧化碳与氧化铁反应生成铁和二氧化碳,反应的化学方程式为:3CO+Fe2O3![]() 2Fe+3CO2;一氧化碳有毒,不能直接排放到空气中去,没有设计尾气处理装置;
2Fe+3CO2;一氧化碳有毒,不能直接排放到空气中去,没有设计尾气处理装置;
(6)铁生锈的主要条件是铁与水和空气直接接触,二者的不同之处是湿棉花和干燥剂,所以得出铁生锈的条件之一是水。