题目内容
【题目】向![]() 溶液中加入m克
溶液中加入m克![]() 和
和![]() 的混合粉末,搅拌,充分反应后过滤、洗涤、干燥得
的混合粉末,搅拌,充分反应后过滤、洗涤、干燥得![]() 固体。向滤液中滴加
固体。向滤液中滴加![]() 溶液,产生白色沉淀。下列说法正确的是( )
溶液,产生白色沉淀。下列说法正确的是( )
A. 滤液的质量是![]() B. 混合粉末的质量范围是
B. 混合粉末的质量范围是![]()
C. 固体中加入稀盐酸可能会有气体生成D. 原![]() 溶液的溶质质量分数是
溶液的溶质质量分数是![]()
【答案】B
【解析】
向![]() 溶液中加入m克
溶液中加入m克![]() 和
和![]() 的混合粉末,搅拌,充分反应后过滤、洗涤、干燥得
的混合粉末,搅拌,充分反应后过滤、洗涤、干燥得![]() 固体。向滤液中滴加
固体。向滤液中滴加![]() 溶液,产生白色沉淀,该反应是铁先与硝酸银反应,铁反应完了,再铜与硝酸银反应,硝酸银与氯化钠反应生成氯化银沉淀和硝酸钠,所以由题意可知,反应结束后,溶液中存在硝酸银溶液,铁、铜完全反应,32.4g固体是反应生成的32.4g的银。
溶液,产生白色沉淀,该反应是铁先与硝酸银反应,铁反应完了,再铜与硝酸银反应,硝酸银与氯化钠反应生成氯化银沉淀和硝酸钠,所以由题意可知,反应结束后,溶液中存在硝酸银溶液,铁、铜完全反应,32.4g固体是反应生成的32.4g的银。
根据以上分析可知:
A、滤液的质量=200g-32.4g+mg=167.4g+mg,故A错误;
B、设:生成32.4g银需要铁的质量为x。

![]() x=8.4g;
x=8.4g;
设:生成32.4g银需要铜的质量为y。
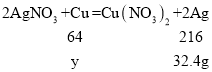
![]() y=9.6g;
y=9.6g;
所以混合粉末的质量范围是![]() ,故B正确;
,故B正确;
C、固体是反应生成的银,银在金属活动顺序中排在氢之后,固体中加入稀盐酸不可能会有气体生成,故C错误;
D、反应结束后,溶液中仍存在硝酸银溶液,题中提供的信息不能计算原![]() 溶液的溶质质量分数,故D错误。故选B。
溶液的溶质质量分数,故D错误。故选B。

【题目】某兴趣小组同学对实验室制取氧气的催化剂进行如下探究:
(提出问题)二氧化锰常作为氯酸钾分解制取氧气的催化剂,其他氧化物是否也能催化氯酸钾分解呢?
(查阅资料)研究表明,许多金属氧化物对氯酸钾的分解(分解时放出热量)有催化作用。分别用下列金属氧化物作催化剂,氯酸钾开始发生分解反应和反应剧烈时的温度如表所示:
氧化铁 | 氧化铝 | 氧化铜 | 氧化镁 | |
开始反应(℃) | 420 | 515 | 305 | 490 |
剧烈反应(℃) | 490 | 540 | 350 | 545 |
(1)实验室用氯酸钾制取氧气,如果不用二氧化锰作催化剂,最好选用的金属氧化物是_____。
(设计并完成实验)Ⅰ.将3.0g氯酸钾放在试管中加热
Ⅱ.将3.0g氯酸钾与1.0g二氧化锰混合均匀加热
Ⅲ.将Xg氯酸钾与1.0g氧化铜混合均匀加热
(2)实验Ⅲ中X的值应为_____,实验_____和Ⅲ比较可证明氧化铜能加快氯酸钾的分解速率。
(实验现象分析)将实验Ⅲ反应后的固体加水溶液、过滤、洗涤、干燥,若称量得到1.0g黑色粉末,再将黑色粉末和Xg氯酸钾混合加热,现象与实验Ⅲ相同。
(3)在相同温度下比较两组实验产生氧气的快慢,通常可采用的方法有_____。
(结论)氧化铜也能做氯酸钾分解的催化剂。
(4)实验Ⅲ反应的文字表达式为_____。
注意:若答对第(5)小题奖励4分,化学试卷总分不超过60分。
(5)氯酸钾分解制取氧气的快慢还与哪些因素有关?请你提出新的合理的假设和实验方案。
(假设)_____。
(实验方案)_____。
(结论)_____。
【题目】下列实验方法能达到实验目的的是( )
选项 | 实验目的 | 实验方法 |
A | 除去 | 点燃 |
B | 鉴别石灰水和 | 通入二氧化碳气体 |
C | 检验一瓶O2是否收集满 | 将带火星的木条伸入瓶中 |
D | 比较 | 将 |
A.AB.BC.CD.D