题目内容
【题目】如图是复方龙胆碳酸氢钠片合的侧面上说明文字,

小明同学为了测定该胃药每片含有碳酸氢钠的质量,(若其它成分不溶于水,也不与酸反应)取20片该胃药,并做如下实验,请回答问题: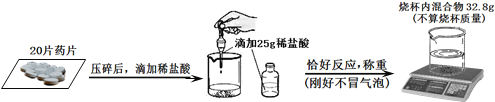
(1)发生反应的化学方程式:__________________________________
(2)根据已知条件列出稀盐酸中溶质质量(x)的比例式_____________________
(3)该胃药中每片含碳酸氢钠_________ g
(4)则所用盐酸的溶质质量分数为________。
【答案】NaHCO3+HCl=NaCl+H2O+CO2↑ ![]() 2.1g 7.3%
2.1g 7.3%
【解析】
(1)根据化学反应的原理来分析解答;
(2)根据化学反应的原理以及溶质质量的计算方法来分析;
(3)根据化学方程式进行计算;
(4)根据计算的数据来分析解答。
解:(1)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为NaHCO3+HCl═NaCl+H2O+CO2↑;
(2)根据质量守恒定律,反应放出二氧化碳的质量=20×0.5g+25g-32.8g=2.2g,设氯化氢的质量为x,碳酸钠的质量为y,则:
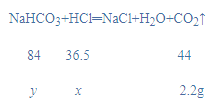
![]()
x=1.825g;
(3)![]() y=4.2g,该胃药中每片含碳酸氢钠的质量为:4.2g÷20片=0.21g/片;
y=4.2g,该胃药中每片含碳酸氢钠的质量为:4.2g÷20片=0.21g/片;
(4)所用盐酸的溶质质量分数为:![]() ×100%=7.3%。
×100%=7.3%。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】某学习小组对CO2展开研究:

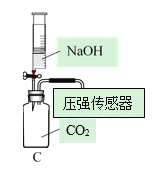
Ⅰ.CO2的制备
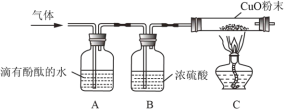
(1)写出图中标号仪器的名称:①______。
(2)实验室制取CO2的反应原理是为______(写化学方程式)。检查A装置的气密性的一种方法是向分液漏斗中加适量水,堵住右侧导气管,打开分液漏斗活塞,若观察到______,则装置不漏气。
(3)实验发现:制取CO2时,最好选用质量分数为7.5%的稀盐酸。现欲配制100g 7.5%的稀盐酸,需要37%(密度为1.18g / mL)的浓盐酸______mL(计算结果精确到小数点后一位),需要水______mL(精确度同上)。量取水时,若仰视读数(其他操作均正确),则所配稀盐酸的质量分数______7.5%(填“>”或“=”或“<”),配制过程不需要的仪器是______。
A.酒精灯 B.量筒 C.烧杯 D.玻璃棒 E.胶头滴管 F.药匙
Ⅱ.CO2的收集
用以下三种方法收集,每种方法均做三次实验,取平均值。将C装置注射器中足量NaOH溶液注入集气瓶中,充分振荡,测集气瓶内气压。(饱和碳酸氢钠溶液可吸收CO2中的HCl气体,NaOH溶液可用来吸收CO2)
方法1:当B装置开始产气泡15s后,用排水法收集 CO2气体,记录集满CO2气体所要的时间为t;
方法2 :当B装置开始产气泡15s后,用向上排空气法收集,收集时间用方法一所用的平均时间t0;
方法3:当B装置开始产气泡15s后,用向上排空气法收集,同时用燃着木条放在集气瓶口,待木条熄灭,立即盖上玻璃片。
实验数据:
方法1 | 方法2 | 方法3 | |
瓶内初始气压(kPa) | 104.2 | 104.2 | 104.2 |
三次实验最终气压平均值(kPa) | 9.3 | 31.8 | 39.7 |
CO2纯度 | 91.1% | 69.5% | X |
数据
(4)三种方法均在15s后开始收集的原因是______。
(5)已知:CO2纯度 =![]() ,则方法3所收集CO2的纯度为______。通过对比,欲收集更高纯度的CO2,应采用______法收集。
,则方法3所收集CO2的纯度为______。通过对比,欲收集更高纯度的CO2,应采用______法收集。
Ⅲ.二氧化碳转化新进展
(6)利用非高热电浆体合成技术可将CO2和甲烷(CH4)反应合成乙酸(CH3COOH),反应的化学方程式为______。
(7)在光催化条件下,CO2和H2反应生成甲烷(CH4)和水,反应的化学方程式为______。